近日,北京未来基因诊断高精尖创新中心(ICG)、北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北大-清华生命科学联合中心张泽民/任仙文课题组在《Cell Research》杂志上发表题为"Reconstruction of cell spatial organization from single-cell RNA sequencing data based on ligand-receptor mediated self-assembly"的文章,提出了预测细胞空间关系的全新生物信息学方法。

随着单细胞转录组测序方法的诞生和日趋完善,单细胞技术在生物医学领域几乎引发了一场革命,在发育、生殖、肿瘤、免疫等各个领域得到了广泛应用,取得了许多重要的生物学发现,并在临床上实现了转化和应用。
然而,单细胞转录组测序技术在提高细胞分辨率的同时,实际上是以牺牲细胞在组织中的空间信息为代价的。如何获取单细胞分辨率下的细胞在组织中的空间信息是当前亟需解决的前沿技术问题。
目前获取单细胞分辨率的细胞空间信息的技术主要通过空间转录组学(Spatial transcriptomics)的方法实现。通过“保留”细胞在组织中的空间信息,空间转录组技术具有真实、可靠的特点,但在细胞和基因的检测通量上低于传统的单细胞转录组测序技术,而且对样本的组织类型也有一定要求,距离广泛应用于各种生物医学场景还存在较大技术瓶颈需要解决。
另一方面,通过“重构”细胞空间关系的生物信息学方法也应运而生,以2015年麻省理工大学和欧洲分子生物学实验室(EMBL)分别在《Nature Biotechnology》上发表的两篇文章为代表。
该类方法以免疫组化技术(IHC)或荧光原位杂交技术(FISH)所揭示的细胞空间信息为参照,利用生物信息学方法将单细胞转录组测序数据映射到组织空间里,其优势在于可以充分利用单细胞转录组测序技术在细胞和基因检测上的通量优势,缺点在于需要免疫组化或荧光原位杂交技术提供参照。
2019年在Nature发表的Gene expression cartography的工作依照“相似细胞相似位置”的假设将参照条件变成了圆或球等几何图形,但依然需要参照。不论空间转录组学技术还是基于参照空间图像信息的生物信息学重构算法,都未触及的一个问题是:细胞在组织中的空间信息是由什么来决定的。
2016年以来,北京大学张泽民教授和任仙文副研究员敏锐地洞察到了这一问题对于单细胞转录组测序数据分析的重要性,决定从由配体-受体介导的细胞-细胞相互作用的角度来回答这一问题,发展一个只基于单细胞转录组测序数据可以“从头重构”(de novo reconstruction)细胞空间关系的生物信息学方法。任仙文副研究员充分发挥其在运筹学与控制论方面的专业优势和对化学领域的质量作用定律(Law of mass action)的理解,将这一问题写成了一个数学优化模型,命名为CSOmap。
该方法的有效性在人和小鼠两种物种上、超过13个单细胞转录组测序数据、包括5种单细胞测序平台、超过16种器官类型甚至包括各种肿瘤上都得到了证实,并在孙育杰教授协助下应用七色免疫组化技术进行了实验验证。
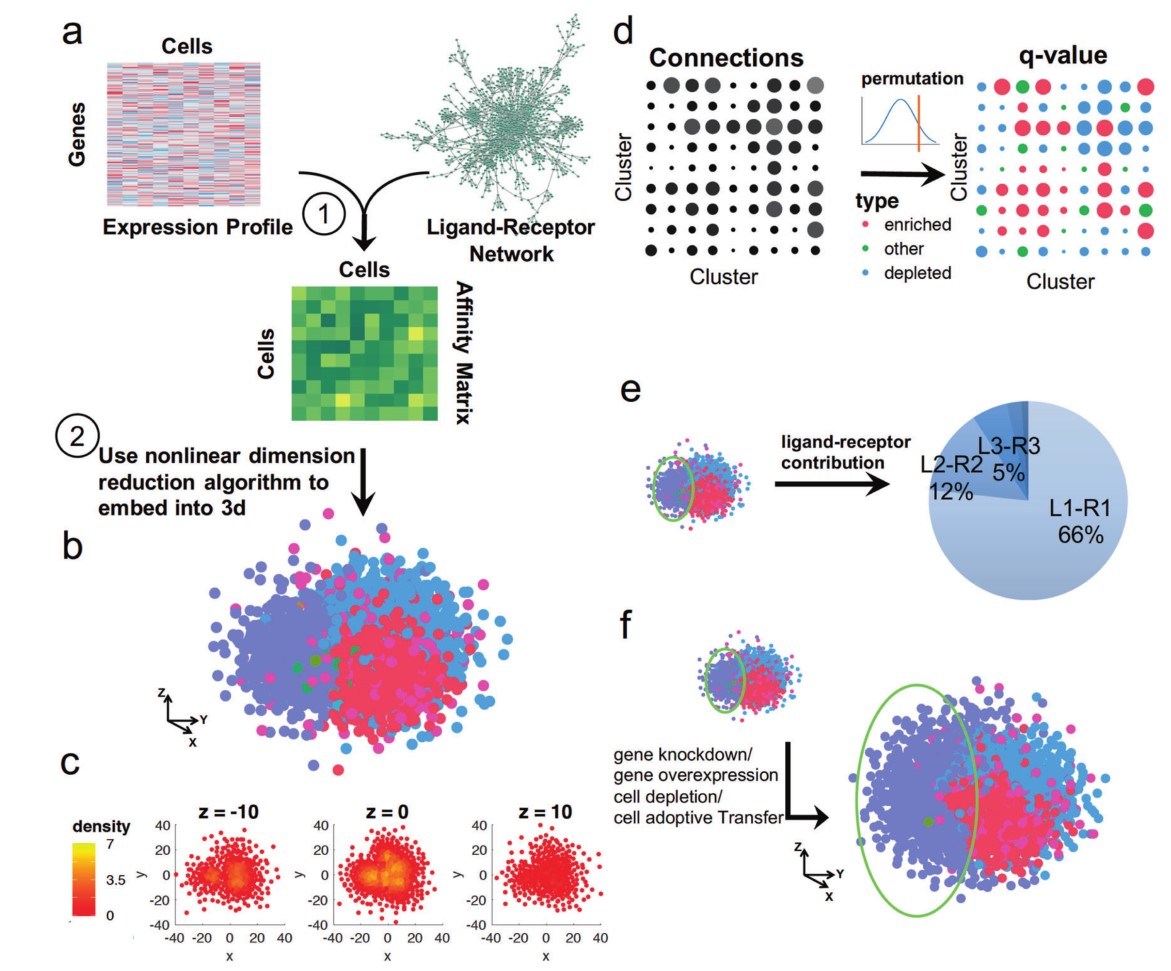
CSOmap从头预测细胞空间关系的计算流程及后续的统计分析、分子机制解析与计算机干扰试验模拟算法示意。
CSOmap的创新性不仅表现在其是领域内第一个不依赖于参照的可以从头重构细胞空间关系的生物信息学方法,尤其体现在其可以回答细胞空间关系是由哪些关键的配体-受体相互作用决定的。
通过在黑色素瘤和头颈癌上的应用,CSOmap预测发现CD63-TIMP1的相互作用在肿瘤形态形成中发挥重要作用,高表达CD63的黑色素瘤会形成比较致密的组织结构,而低表达CD63的头颈癌会形成松散的肿瘤结构以利于转移扩散。该发现被前不见刚发表的关于黑色素瘤的体内体外实验所证实和支持。CSOmap在应用于肿瘤浸润T细胞的研究时发现CCL5-CCR8对于调节性T细胞浸润到肿瘤调控耗竭性T细胞具有重要的作用,为新型靶点发现提供了重要线索。
CSOmap的另一个创新之处在于首次实现了计算机干扰实验(in silico perturbation)以检验特定基因或细胞群对细胞空间关系的影响。这些干扰试验可以是特定基因的高表达、敲低,也可以是某种细胞类群的靶向去除或者加入。
通过应用于肿瘤浸润T细胞的单细胞测序数据集,CSOmap发现肿瘤浸润调节性T细胞的去除对于外周血中的CD8+和CD4+效应T细胞通过CCL4-CXCR3进入肿瘤执行功能具有重要作用。该发现重现了美国Roswell Park Cancer Institute的S.S. Evans教授2015年的发现,并给出了更多的洞见。
用CSOmap模拟过继性T细胞输入疗法(adoptive T cell transfer)发现T细胞在肿瘤中的浸润会形成一道特殊的肿瘤细胞-T细胞的界面(interface),而这种浸润和T细胞的表型与癌种的差别都存在显著联系。由于伦理和技术条件的限制,这些发现在人体上几乎很难做到,这进一步彰显了CSOmap实现的计算机干扰实验的价值。
总而言之,张泽民/任仙文团队巧妙地利用了配体-受体相互作用,首次实现了一种可以从头预测细胞空间关系的单细胞转录组测序数据分析方法,解除了原来方法需要参照数据的限制,并实现了统计推断、分析决定性分子基础、模拟干扰实验等功能,在人和小鼠的各种器官及病变条件下进行了验证,取得了一些全新的洞见。该方法对于进一步深入挖掘单细胞转录组测序所蕴含的丰富生物医学知识具有重要意义。
据悉,该文章的共同第一作者钟国杰还是一名本科生,负责了软件的编写工作和部分数据分析任务,目前在美国哥伦比亚大学攻读博士学位。任仙文副研究员是论文的第一作者和共同通讯作者,张泽民教授是通讯作者。



