人类胚胎发育是一个极其复杂的过程,从一个单细胞的受精卵开始,首先经过着床前胚胎发育产生胚内和胚外组织,再到着床后原肠胚阶段三个胚层的特化,进而到器官发生、分化、成熟,及至新生命的诞生。整个两百八十天的胚胎发育过程从一个单细胞受精卵增殖发育形成含有上万亿个细胞的婴儿,期间基因表达受到严密、精准的调控,这一过程中的基因表达调控机制仍然亟需深入研究。
从2010年起,北京大学生物医学前沿创新中心、北京未来基因诊断高精尖创新中心汤富酬课题组和北医三院乔杰课题组紧密合作,围绕人类生殖系细胞(包括着床前胚胎细胞和着床后胚胎生殖细胞)发育的基因表达调控机制开展了一系列深入的研究。利用汤富酬课题组发展的单细胞转录组高通量测序技术,他们绘制了完整的人类生殖系细胞的发育细胞图谱(着床前胚胎的发育细胞图谱[Yan et al., Nature Structural & Molecular Biology, 2013; Dang et al., Genome Biology, 2016];着床后胚胎生殖细胞的发育细胞图谱[Guo et al., Cell, 2015; Li et al., Cell Stem Cell, 2017]),并对其DNA甲基化、染色质状态等不同层面的表观遗传学调控机制进行了深入的研究(Guo et al., Nature, 2014; Guo et al., Cell Research, 2017; Zhu et al., Nature Genetics, 2018; Li et al., Nature Cell Biology, 2018)。2018年,这两个团队还与南方医科大学赵小阳课题组合作完成了人类成年男性精子发生过程中的细胞命运转变和基因表达图谱的绘制,为男性不育的临床诊断提供了新的思路(Wang et al., Cell Stem Cell, 2018)。
此后两个团队继续合作,全面开展人类生殖系细胞以及非生殖系的各种重要器官的发育细胞图谱研究,目标是最终获得人类胚胎发育所有重要阶段、所有主要器官系统的高精度发育细胞图谱。2018年,他们与中科院生物物理所王晓群课题组等合作首次绘制了来自外胚层的人脑前额叶发育的单细胞图谱,并揭示了神经元分化的成熟机制(Zhong et al., Nature, 2018);同时,他们还对人类胚胎大脑皮层的所有主要脑区进行了单细胞转录组研究,并揭示了大脑皮层的区域化基因表达和神经元成熟的重要特征 (Fan et al., Cell Research, 2018)。以上这些工作为绘制完整的人脑发育细胞图谱奠定了重要的基础。此外,这两个团队紧密合作,系统地阐明了来自内胚层的消化道四种主要器官(食道、胃、小肠和大肠)在人类胚胎发育过程中的基因表达图谱及其信号调控机制,并进一步解析了从胎儿到成年大肠的发育、成熟路径和关键生物学特征 (Gao et al., Nature Cell Biology, 2018)。2018年,这两个团队还合作开展了对来自中胚层的肾脏的发育细胞图谱研究,深入研究了完整肾单位的细胞分化发育过程,阐释了由肾单位前体细胞逐步分化产生不同类型的肾小管上皮细胞过程中对应的转录调控事件和信号通路调节机制(Wang et al., Cell Reports, 2018)。
2019年2月12日,北京大学未来基因诊断高精尖创新中心汤富酬课题组与北医三院乔杰课题组继续紧密合作,在《Cell Reports》杂志发表了题为“Single-Cell Transcriptome Analysis Maps the Developmental Track of the Human Heart”(利用单细胞转录组分析技术绘制人类心脏发育路线图)的研究成果,对来自中胚层的另一重要器官——心脏进行了深入的发育细胞图谱研究。
心脏是哺乳动物在胚胎期最先形成的功能器官之一。尽管已有对小鼠胚胎心脏发育的大量系统研究,但是人类与小鼠的心脏存在着很大差异(例如小鼠的心率是每分钟600-700次,比人类的心率快近10倍),这提示人类心脏发育过程有其不同于小鼠模型的独特特征。基于此,该课题组利用高精度单细胞转录组测序技术对人类胚胎5周至25周心脏的4000多个单细胞进行了系统的分析(如图1所示),为阐明人类心脏发育的机制奠定了基础,并为心脏再生的研究提供了重要线索。该研究的主要发现有:
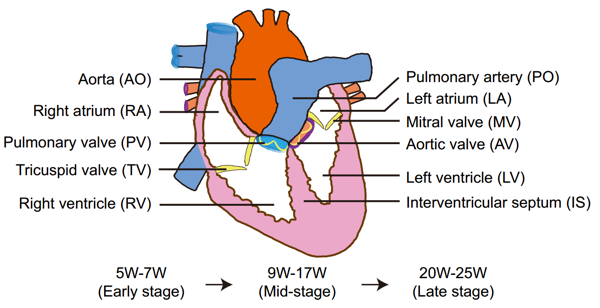
图1. 人类心脏解剖示意图
1. 系统揭示了人类胚胎心脏发育主要细胞类型的关键时空发育特征
该研究系统鉴定了人类胚胎期心脏的主要细胞类型,包括心肌细胞、成纤维细胞、内皮细胞、瓣膜细胞、心外膜细胞、平滑肌细胞以及各种免疫细胞(包括肥大细胞、巨噬细胞、T细胞和B细胞),揭示了每种细胞类型独特的基因表达模式,以及各种细胞类型在发育过程中的丰度变化等重要生物学特征。随着心脏发育进展,心房、心室中的心肌细胞比例显著下降,成纤维细胞、巨噬细胞等非心肌细胞的比例逐渐上升,这说明在发育过程中成纤维细胞等非心肌类型细胞对心脏发育的作用可能越来越重要(如图2所示)。
心脏瓣膜由内皮细胞和瓣膜间质细胞两种细胞类型构成。该研究发现瓣膜间质细胞在发育至20周左右时,有明显的细胞凋亡发生,这与心脏瓣膜的发育塑形密切相关。该研究还发现心脏的内皮细胞根据空间位置分为心内膜内皮细胞、血管内皮细胞、冠状动脉内皮细胞以及瓣膜内皮细胞,显示出了内皮细胞类型的异质性以及微环境特异性。
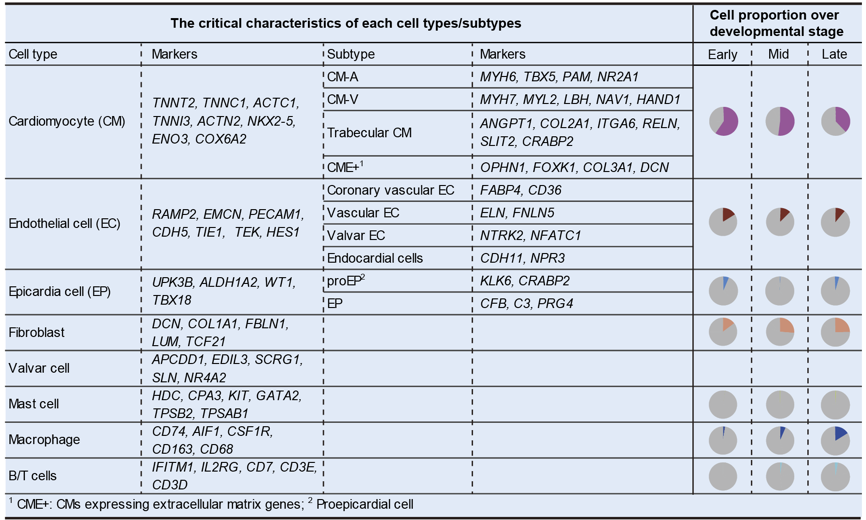
图2. 人类胚胎发育过程中各种细胞类型的基因表达特点及丰度变化
心脏壁主要由心肌细胞构成。在发育过程中,心脏会经历由松散心肌小梁重构形成紧实心肌层的成熟过程,该研究鉴定了这其间心肌小梁和紧实层心肌细胞的重要基因表达差异。此外,还发现心肌细胞解剖位置(心房与心室之间,左心房与右心房之间,以及左心室与右心室之间)特异性的基因表达特点,而这些特点在早至胚胎发育第5周时就已经有明确显现。
2. 揭示了心肌细胞和成纤维细胞功能成熟过程的重要特征
心脏发育过程中,心肌细胞和成纤维细胞呈现出明显随发育时期的变化趋势,最显著的特点是活跃增殖的细胞比例大幅度下降,细胞外基质相关的一系列基因表达的协同上调 (如图3所示),揭示了心肌细胞和成纤维细胞功能成熟的重要标志和关键分子事件。这也为研究人类多能性干细胞体外分化为功能成熟的心肌细胞提供了高精度的参比标准。
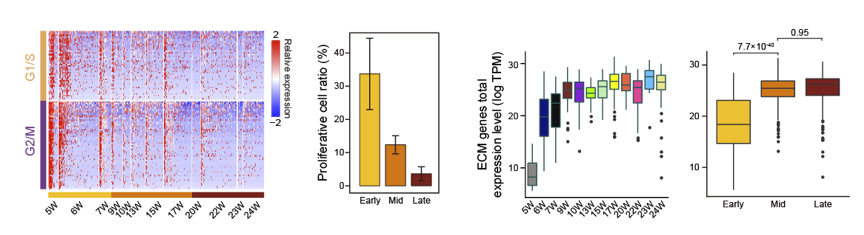
图3. 心脏成纤维细胞发育过程中的基因表达变化特征
3. 揭示了心脏发育过程中关键信号通路在不同细胞类型之间的协同互作机制
在心脏发育过程中,有多条信号通路在不同细胞类型中被依次有序激活。该研究发现在心脏发育过程中,NOTCH信号通路主要通过ERBB信号调控心肌致密化,促进心肌细胞的分化。而在内皮细胞和成纤维细胞中,主要通过心肌细胞分泌的BMP5和BMP7信号分子,激活这两种非心肌细胞中的BMP信号通路,促进其命运分化和功能成熟。这说明在心脏发育过程中心肌细胞与内皮细胞、成纤维细胞等非心肌细胞之间存在复杂的信号通路协同互作,共同实现了心脏的稳步发育壮大和协同功能成熟。
4. 系统揭示了人类心脏发育不同于小鼠模型的独特基因表达特征
该研究通过与已经发表的小鼠心脏发育的单细胞转录组数据进行系统比较,鉴定出一系列人类心脏发育过程中主要细胞类型特异表达的重要基因,比如在人类心脏中,FGF12在心肌细胞中、RNASE1在内皮细胞中、THY1在成纤维细胞中、CFB和ITLN1在心外膜细胞中特异高表达,而这些基因在小鼠心脏对应细胞类型中几乎不表达,是人类特异性的心脏发育重要调控基因;而在小鼠心脏中, Icam2在内皮细胞中、Itga4在成纤维细胞中、Hpgd在心外膜细胞中特异高表达,而这些基因在人类心脏对应细胞类型中几乎不表达,是小鼠特异性的心脏发育重要调控基因(如图4A所示)。该研究还发现人类与小鼠的心脏中心肌细胞是最为相似的细胞类型,而成纤维细胞等细胞类型的物种间差异较大(如图4B所示)这为利用小鼠模型研究人类的心脏发育提供了参比标准。
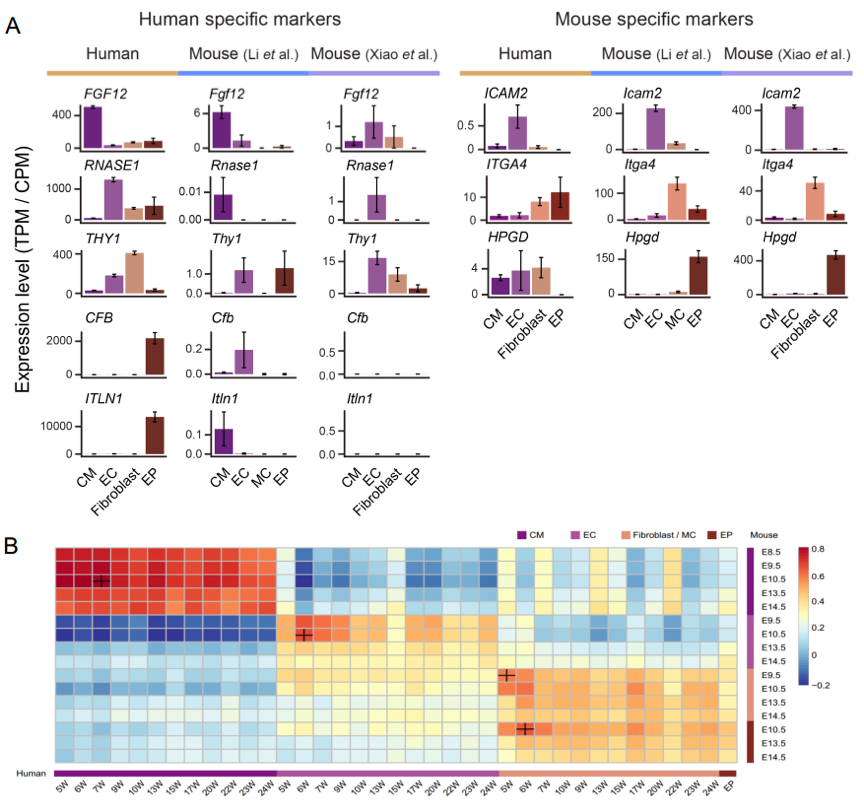
图4. 人类与小鼠胚胎期心脏发育的物种特异性基因表达特征
总之,该研究利用高精度的单细胞转录组测序等技术,全面、系统地解析了人类心脏发育过程中主要细胞类型的重要生物学特点,揭示了心脏发育过程中关键信号通路的时空特异性激活特征以及心肌细胞与非心肌细胞之间的复杂信号互作机制,同时通过与已发表的小鼠心脏发育单细胞转录组数据的系统比较,揭示了人类心脏发育不同于小鼠模型的独特基因表达特征。该研究深化了对人类心脏发育机制的理解,并为研究人类多能性干细胞体外分化为功能成熟的心肌细胞提供了高精度的参比标准。
北京大学生物医学前沿创新中心、北京未来基因诊断高精尖创新中心博士生崔月利、郑宇轩和柳溪溪为该论文的并列第一作者,汤富酬教授和乔杰教授为该论文的共同通讯作者。该项工作得到了国家重大科学研究计划、国家自然科学基金委、未来基因诊断高精尖创新中心以及生命科学联合中心(CLS)等的支持。



