2018年11月21日,国际著名学术期刊Cell子刊Molecular Cell以长文在线发表了BIOPIC白凡课题组关于细菌耐药机制的重要研究成果。在题为“ATP-dependent dynamic protein aggregation regulates bacterial dormancy depth critical for antibiotic tolerance” 的研究论文中,研究人员通过综合应用单细胞活体荧光成像技术和高通量质谱鉴定手段,发现了蛋白质沉淀聚合体的形成和解聚在调控细菌耐药和复苏过程中的关键作用,并进一步揭示细菌细胞的关键生理指标-ATP浓度的动态变化是促使蛋白质沉淀聚合体产生的分子机制。
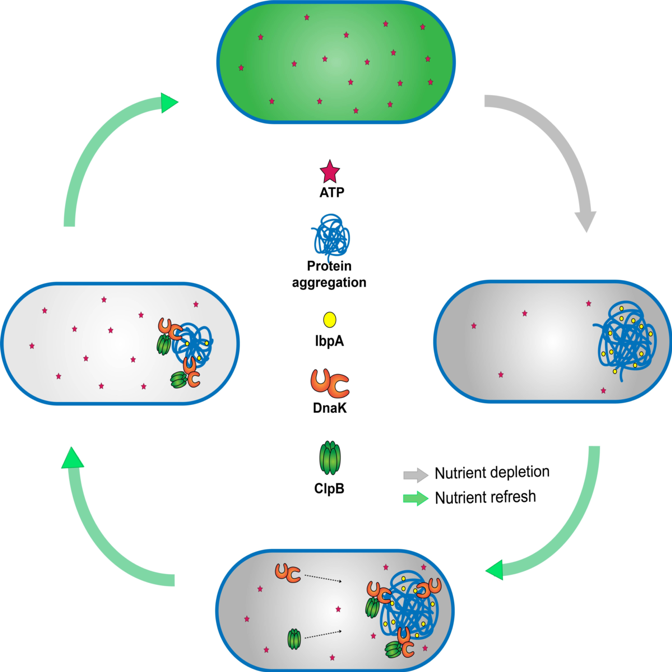
细菌内ATP浓度的动态变化促使蛋白质沉淀聚合体的形成和解聚,调控细菌的休眠深度,帮助细菌耐药及复苏
细菌的耐药性是一种现象,具有同样基因组的细菌群体通过异质性的基因表达产生了一个细胞亚群,称为持留菌(persister),它们能耐受抗生素治疗。持留菌形成的机制一直是细菌学研究中的热点。之前,持留菌的形成一直归因于细胞的休眠状态和生长停滞。在这些生理情况下,尽管抗生素结合到了其作用靶点,但由于细胞的代谢缓慢,抗生素无法对细菌造成伤害。在最新的研究中,研究人员通过在显微镜下对耐药细菌在撤除抗生素后复苏生长过程的单细胞观测,发现每个持留菌表现出不同的休眠深度(dormancy depth),从而调控持留菌复苏生长所需时间的快慢。
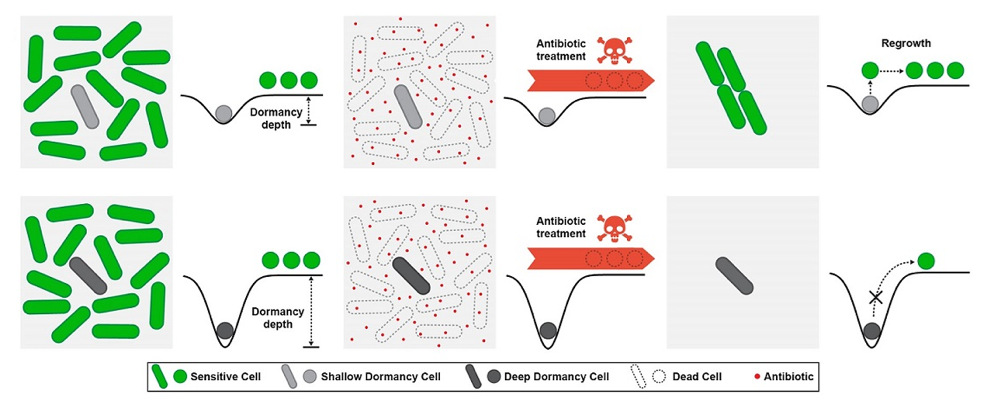
休眠状态帮助细菌躲过抗生素攻击,但休眠深度决定耐药菌能否以及多久复苏生长
通过进一步的单细胞实时动态观察,研究人员意外地发现伴随着细菌休眠深度的加深,细菌细胞内会出现明显的“小黑点”。通过蛋白荧光标记和高通量质谱鉴定,这些小黑点被证明是大量蛋白质沉淀产生的聚合体(aggresome)。沉淀聚合体的形成,导致细菌进入深度休眠状态;而当细菌需要复苏生长时,沉淀聚合体需要首先解聚,恢复细菌细胞内的蛋白质平衡分布。
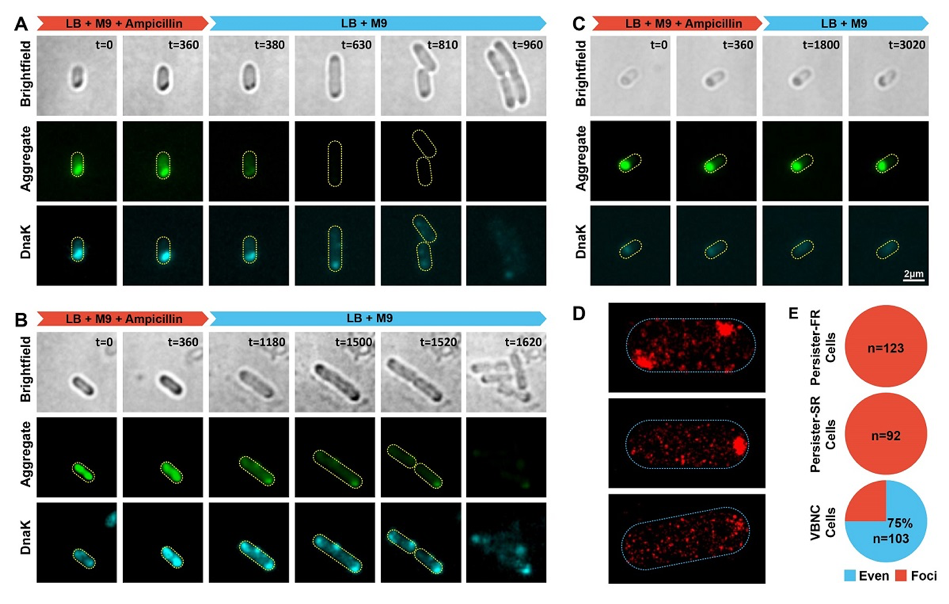
细胞内ATP耗竭导致蛋白质沉淀聚合体的形成,当ATP重新产生后解聚沉淀聚合体还需要DnaK-ClpB蛋白的协助
之后,研究人员通过大量的单细胞实时荧光成像和分子生物学实验,深入揭示细菌细胞内ATP的耗竭,是导致蛋白质沉淀聚合体产生的分子机制。而当ATP得到补充,细菌准备复苏生长时,还需要两个重要的蛋白DnaK和ClpB协助沉淀聚合体的解聚。这项工作系统地阐明了耐药细菌进入不同休眠深度的表型差异和分子机制,首次揭示了决定细菌复苏生长所需时间快慢的关键生物学过程,并为消除细菌耐药提供了新的思路和药物靶标。
这项工作是白凡课题组继在2016年揭示外排泵在细菌耐药中发挥重要作用(Pu et al., Molecular Cell62 (2016), pp. 284-294. highlighted by ‘Microbiology: Pumping persisters’, Nature;‘Persisters are under the pump’, Nature Reviews Microbiology)之后在细菌耐药领域的又一重要突破。
北京大学生物医学前沿创新中心(BIOPIC)白凡研究员为该论文的通讯作者。北京大学BIOPIC助理研究员普颖颖博士、博士毕业生李颖星、博士后金心、在读博士生田甜为该论文的并列第一作者。本项研究得到了国家自然科学基金(No. 31722003, No. 31770925, No. 31370847),科技部重大研究专项(No. 2017ZX10304402),和Human Frontier Science Program Grant (RGP 0041/2015)的支持。
原文链接:Pu Y#, Li Y#, Jin X#, Tian T#, Ma Q, Zhao Z, Lin S, Chen Z, Li B, Leake MC, Lo CJ, Bai F*, ATP-dependent dynamic protein aggregation regulates bacterial dormancy depth critical for antibiotic tolerance, Molecular Cell73 (2019), pp. 1-14 (November. 21.2018 online)



