2017年4月27日,北京大学生命科学学院生物动态光学成像中心汤富酬课题组与北医三院乔杰课题组在《Cell Stem Cell》杂志在线发表了题为“Single-Cell RNA-Seq Analysis Maps Development of Human Germline Cells and Gonadal Niche Interactions” 的研究论文,首次在单细胞分辨率和全转录组水平,系统阐明了人类胚胎性腺中生殖细胞及其微环境细胞发育过程中的基因表达图谱及其调控机理。

图1:图片设计源于中国古代生殖图腾-女娲和伏羲,在此代表人类雌雄胚胎生殖细胞。日月亦象征胚胎生殖细胞,而星辰则象征与其互作的体细胞。整幅画面传递着生命伊始这一含义。
胚胎生殖细胞是精子和卵细胞在胚胎期的前体细胞,其正常发育对于遗传信息在亲代与子代之间的稳定传递以及物种延续起着至关重要的作用。对人类胚胎期生殖细胞发育进程的深入研究能够促进我们对于生殖细胞发育异常、不孕不育等相关疾病的了解与治疗。在过去几年中,汤富酬课题组与乔杰课题组一直紧密合作,运用微量细胞DNA甲基化组高通量测序和单细胞转录组高通量测序等技术,首次在单碱基分辨率和全基因组水平,全面揭示了人类胚胎生殖细胞在多个关键发育阶段的大规模DNA甲基化组重编程过程、及其对基因表达的调控关系,并且发现了人类胚胎生殖细胞不同于小鼠胚胎生殖细胞的关键独特特征。他们发现在DNA甲基化组重编程过程中,DNA甲基化与基因转录调控发生脱扣,这样DNA甲基化在被大规模擦除过程中基因的转录基本不受影响,各种组蛋白共价修饰在此期间维持着转录组的高度稳定性。相关研究成果以封面文章的形式发表在2015年6月的《Cell》杂志上。
在此基础上,两个课题组继续深入研究,采用优化的微量细胞NOMe-seq(全基因组核小体定位及DNA甲基化组测序)技术,系统分析了人类胚胎生殖细胞多个关键发育阶段的染色质状态组的动态变化。作为对照,他们也系统分析了对应发育阶段的小鼠胚胎生殖细胞的染色质状态组的动态变化。通过进化比对分析,揭示了人类和小鼠胚胎生殖细胞染色质状态组、DNA甲基化组参与基因表达调控的进化保守性特征以及物种特异性特征。他们还发现了十几万个人类生殖细胞胚胎阶段特异性的开放染色质区域,推测其中大部分为全新的人类胚胎生殖细胞特异性激活的增强子调控元件,这为解析增强子对于人类生殖细胞体内发育的调控机理打下了坚实的基础。相关研究成果已在线发表在2016年11月的《Cell Research》杂志上。虽然该研究团队2015年6月发表在《Cell》上的文章中已经对人类胚胎生殖细胞及其微环境细胞的三百多个单细胞进行了转录组分析,但是胚胎生殖细胞精确的发育历程,特别是减数分裂阶段的发育异质性和核心基因表达特征还没有被阐明。
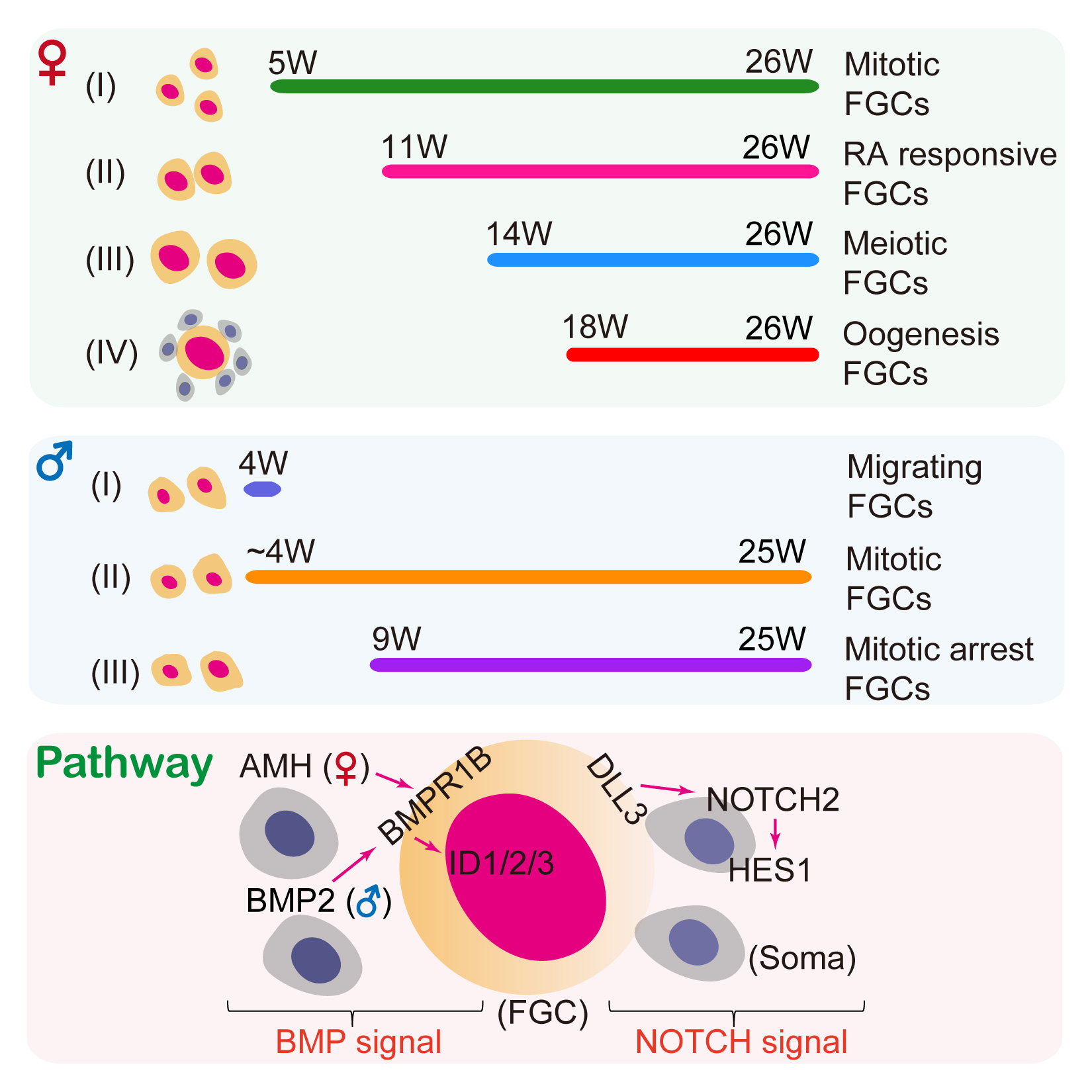
图2:人类胚胎生殖细胞的发育过程概览。
在上述研究的基础上,汤富酬课题组与乔杰课题组继续深入合作,运用免疫磁珠细胞分离技术(MACS)、流式细胞分选技术(FACS)、以及优化了的单细胞转录组高通量测序技术对从妊娠4周到26周的人类胚胎生殖细胞及其微环境细胞的两千多个单细胞进行了系统的转录组测序分析,并通过后续的功能实验对性腺中生殖细胞的分布与定位、以及细胞亚群的精确比例关系等关键特征进行了系统的分析。该项研究发现:
(一)定植到性腺后,人类雌性胚胎生殖细胞经历四个关键的发育阶段:(1)有丝分裂阶段、(2)视黄酸信号响应阶段、(3)减数分裂前期阶段、(4)原始卵泡生成阶段。定植到性腺后,人类雄性胚胎生殖细胞经历两个关键的发育阶段:(1)有丝分裂阶段、(2)有丝分裂阻滞阶段。有趣的是,妊娠后18周的胚胎卵巢中就已经开始出现原始卵泡阶段的生殖细胞,并且在从18周到26周的胚胎卵巢中,从早期有丝分裂阶段直到晚期原始卵泡阶段所有四个发育阶段的生殖细胞在同一个性腺中共存。类似的,从13周到25周的胚胎睾丸中,早期有丝分裂阶段和晚期有丝分裂阻滞阶段的生殖细胞在同一个性腺中共存。这表明人类胚胎生殖细胞的发育进程在时间上是不同步的,会经过一个复杂而有序的异步发育过程。
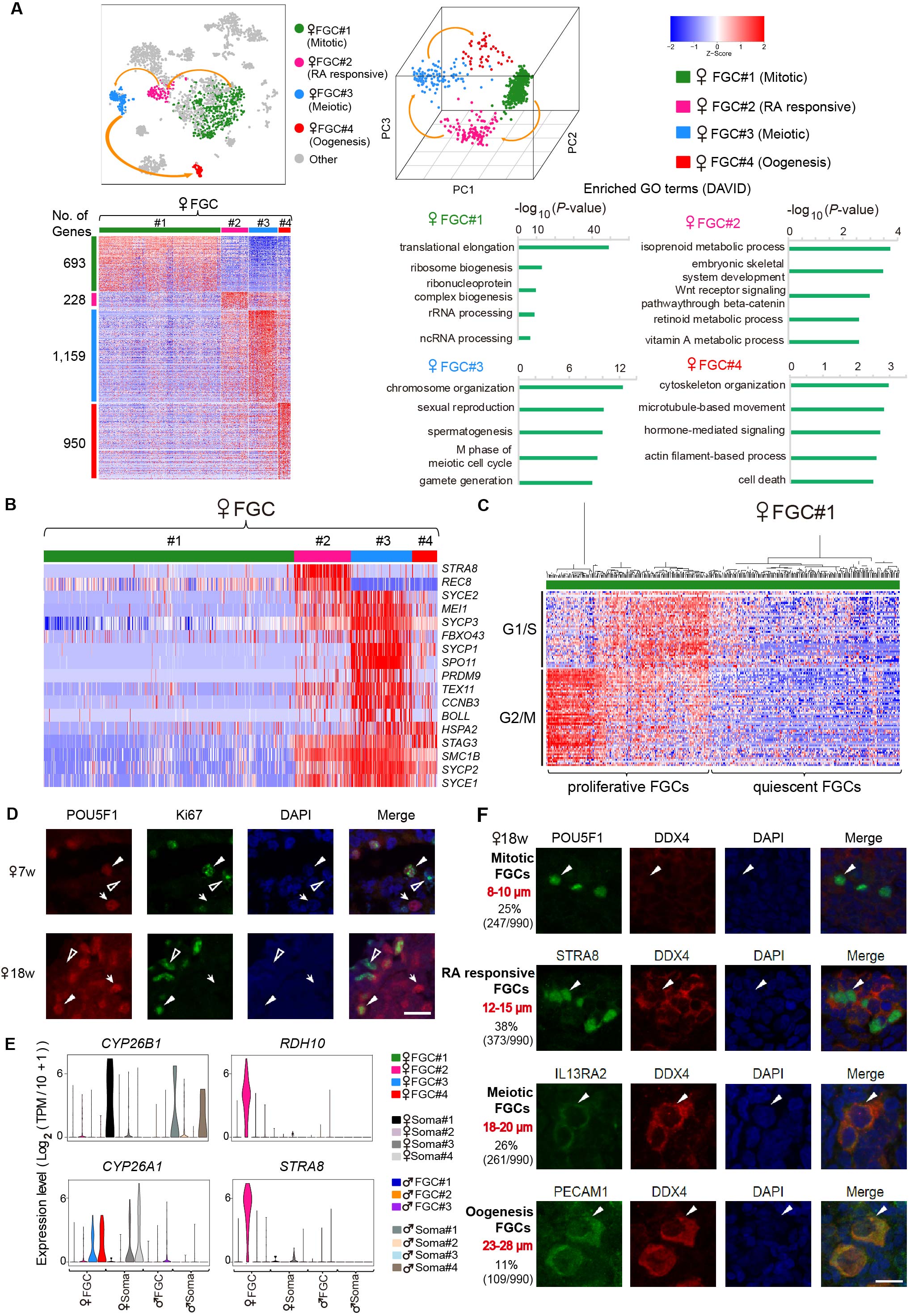
图3:人类雌性胚胎生殖细胞动态基因表达模式。
(二)准确鉴定出了人类胚胎雌性性腺中的4种关键类型的微环境细胞:性腺内皮细胞、早期颗粒细胞、晚期颗粒细胞、以及壁颗粒细胞。同时也准确鉴定出了人类胚胎雄性性腺中的4种关键类型的微环境细胞:性腺内皮细胞、支持细胞、间质前体细胞、以及成熟间质细胞。在此基础上,系统鉴定了这8种性腺微环境细胞的转录特征、表面标志、信号通路活性以及核心转录因子网络。
(三)在单细胞水平系统分析了以上各种类型性腺细胞在发育过程中重要的基因表达模式,并且运用ARACNe (the Algorithm for the Reconstruction of Accurate Cellular Networks)方法分析鉴定出在各个关键发育阶段雌性和雄性生殖细胞中可能起核心调控作用的转录因子网络。例如,MALE和ZGLP1在视黄酸信号响应阶段的雌性生殖细胞中可能起关键调控作用;FIGLA和STAT1对于原始卵泡生成阶段的雌性生殖细胞的发育可能至关重要。
(四)准确鉴定出人类胚胎生殖细胞与性腺微环境细胞之间通过BMP和NOTCH等信号通路进行相互调控,协同维持性腺发育的稳定性和连续性。特别是该研究发现在同一个胚胎中的早期阶段生殖细胞与晚期阶段生殖细胞之间通过NORDAL等信号通路相互作用,共同维持二者之间的动态平衡。
(五)视黄酸信号通路的精确调控对于生殖细胞进入减数分裂至关重要。通过对视黄酸信号通路中的相关基因表达进行系统的分析,该研究首次发现:合成视黄酸的基因RDH10在雌性生殖细胞中的表达水平明显高于雄性生殖细胞,降解视黄酸的基因CYP26A1在视黄酸信号响应阶段和减数分裂前期阶段的雌性生殖细胞中上调。该研究表明视黄酸的快速合成与及时降解之间的精确动态平衡对于人类雌性生殖细胞进入减数分裂起重要调控作用。
(六)通过对与细胞周期阻滞相关基因的表达情况进行分析,该研究发现NANOS2,CDKN2B和CDK6等基因对于人类胚胎期雄性生殖细胞进入有丝分裂阻滞阶段可能起关键调控作用。
(七)运用免疫荧光染色技术对18周人类胚胎卵巢组织中的四种主要类型生殖细胞进行分析发现:随着发育的进行,人类胚胎生殖细胞的大小会逐渐增大,由有丝分裂阶段的8-10 μm到原始卵泡发生阶段的23-28 μm;有丝分裂期和视黄酸信号响应期的胚胎生殖细胞大多分布在卵巢皮质的周边区域,减数分裂前期和原始卵泡生成期的胚胎生殖细胞的分布则更靠近卵巢中心(髓质)的区域;四种胚胎生殖细胞数量的比例依次是25%,40%,25%,10%。而18周的胚胎睾丸组织中有丝分裂阶段和分裂阻滞阶段的生殖细胞的比例分别为40%和60%。
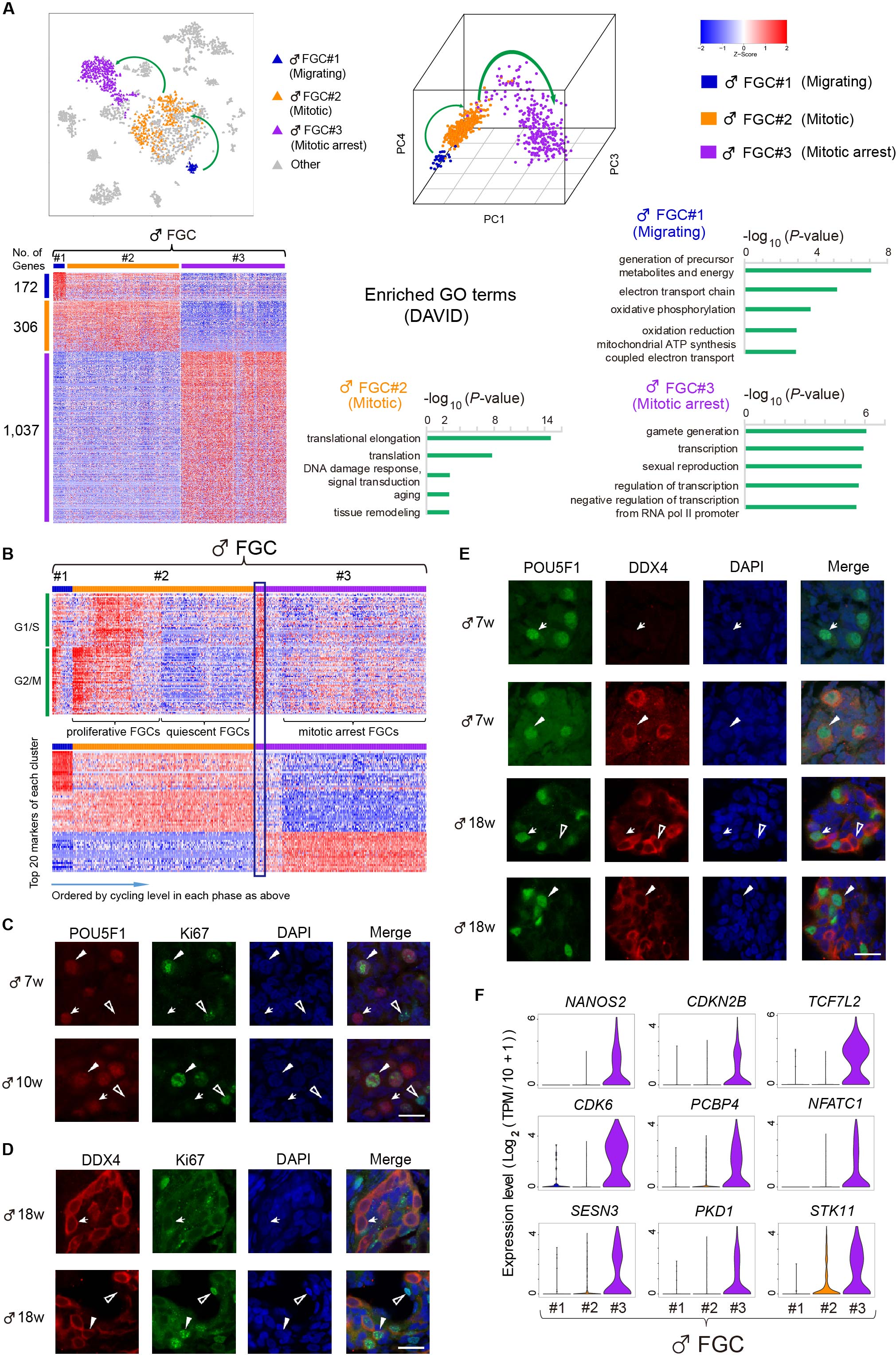
图4:人类雄性胚胎生殖细胞动态基因表达模式。
该研究对人类胚胎生殖细胞在妊娠4周到26周的长达五个月的发育关键期的转录组进行了全面、系统、深入的解析与阐释,深化了对于人类生殖系细胞的有丝分裂、减数分裂、卵泡发生、细胞迁移、性别分化、生殖细胞-微环境细胞互作等一系列关键的生殖生物学过程的理解;特别是加深了对于生殖系-非生殖系细胞在性腺发育过程中的互动与协同调控机理的理解。该研究对高度动态但又精确协调的核心转录因子以及信号通路的解析为多能性干细胞体外定向分化为生殖细胞研究提供了非常有价值的线索。该项研究描绘的体内正常生理情况下人类胚胎生殖细胞的发育历程将为生殖细胞相关疾病(如不孕不育和畸胎瘤等)的诊断和治疗提供路标。
北京大学生命科学学院博士生李莉、董骥和北医三院生殖中心闫丽盈博士为该论文的并列第一作者。汤富酬研究员和乔杰教授为该论文的共同通讯作者。该项研究得到了国家自然科学基金、国家基础研究计划、北京市科学技术委员会、国家高技术研究发展计划、北京未来基因诊断高精尖创新中心、以及北大-清华联合中心的资助。



