基因的功能探索是生命科学研究的永恒主题。近几年以CRISPR-Cas9为代表的基因组编辑技术让直接在高等生物体内进行基因的功能筛选成为可能 (Shalem, et al. Science 2014; Wang, et al. Science 2014; Koike-Yusa, et al. Nature Biotechnol 2014; Zhou et al, Nature 2014)。然而,蛋白编码基因仅占3%不到的基因组,研究者发现越来越多的非编码元件在生命活动中发挥极其重要的作用,比如非编码RNA、特别是长非编码RNA(lncRNA)的异常与癌症等很多疾病的发生发展相关。遗憾的是在已经注释的超过两万多lncRNA中,绝大部分长非编码RNA的功能未知,如何实现这类基因组元件的功能筛选已经成为当前的研究热点。
对编码蛋白基因的敲除可以通过基因组编辑技术对目标区域实行单点切割、引入小片段插入或缺失(indels)以造成基因翻译读码框破坏,然而这一方法对于不依赖读码框的非编码元件作用有限。尽管有报道称用sgRNA文库通过饱和筛选研究单个或者少量基因的调控元件(Canver M.C. et al., Nature, 2015; Neville E. Sanjana et al., Science, 2016),但是在基因组水平上实现非编码元件的大规模筛选,依然缺乏有效的技术手段。
北京大学生命科学学院、北大生物动态光学成像中心魏文胜研究组和哈佛大学公共卫生学院刘小乐 (Shirley Liu) 研究组合作,建立了paired-guide RNA (pgRNA) 文库的构建方法,通过pgRNA引入的基因组大片段删除来破坏lncRNA表达及功能,并由慢病毒介导在多个癌细胞系中实现了功能筛选,从~12,000 pgRNA 的CRISPR文库 中成功鉴定出正向及负向调控癌细胞增殖的lncRNA。论文通过多种遗传学手段验证了候选lncRNA的功能,并通过生物信息分析和表达谱测序探究了其发挥作用的机制。有趣的是,通过分析候选lncRNA在肿瘤细胞发展不同阶段的表达水平,发现筛选得到的正向调控细胞增殖的lncRNA发挥致癌作用,而负向调控细胞增殖的lncRNA发挥抑癌作用。这是首次实现对于非编码元件的基因组水平的功能筛选,这一高通量技术平台的建立不仅有助于人们研究影响细胞增殖的非编码元件,还可以用于筛选发挥其他重要作用的非编码元件或者基因组中的功能未注释区域。
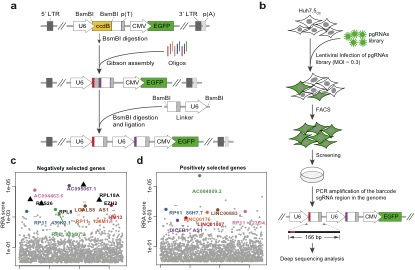
CRISPR 大片段DNA序列删除文库的构建和对lncRNA的高通量功能性筛选。
(a) pgRNA文库克隆构建方法。 (b) pgRNA文库筛选影响细胞增殖lncRNA的流程。(c) 负向筛选获得的候选基因。(d) 正向筛选获得的候选基因。
该研究于10月31日在线发表于Nature Biotechnology (Genome-scale deletion screening of human long non-coding RNAs using a paired-guide RNA CRISPR–Cas9 library)。北京大学生命科学学院博士生朱诗优(PTN12级)和哈佛大学公共卫生学院博士后李炜为该论文共同第一作者,魏文胜和刘小乐教授为共同通讯作者。该研究项目的北大课题组得到了国家自然科学基金(重点及面上项目)、北大-清华生命科学联合中心、北京未来基因诊断高精尖创新中心的基金支持。
文章链接http://www.nature.com/nbt/journal/vaop/ncurrent/full/nbt.3715.html



