结直肠癌是最多发的癌症之一,病死率高居全球第二。目前,利用患者肿瘤组织构建的类器官模型已成为研究肿瘤发生分子机制的常用研究手段。多种肿瘤类器官已被成功构建,包括结直肠癌、乳腺癌、膀胱癌、前列腺癌、胃癌等。然而,这些研究大部分仅在大量细胞系综平均的水平评估了患者组织衍生的类器官的各种分子特征,如基因突变,基因组拷贝数变异以及基因表达等变化,并未在单细胞水平进行评估,从而无法系统地评估构建的类器官个体内部的肿瘤细胞异质性情况,特别是由于构建类器官的成功率常常不是很高,同时得到同一个患者的体内肿瘤单细胞组学数据以及在体外建成类器官后的配对单细胞组学数据非常困难。
为了系统评估结直肠癌类器官培养系统,解析类器官与对应的体内肿瘤上皮细胞之间的异同以及不同培养体系对类器官基因表达特征的影响,北京大学生物医学前沿创新中心(BIOPIC)汤富酬团队与北京大学第三医院普外科付卫团队合作,对来自6名结直肠癌患者的体内肿瘤组织和癌旁正常组织,以及对它们体外培养建立的相应的类器官进行了高精度单细胞转录组测序,并结合全基因组甲基化测序、全基因组测序、全外显子组测序以及靶位点Sanger测序等,对两种常见结直肠类器官培养体系从转录组、基因组和DNA甲基化组三个层面进行了系统的比较和评估(图1)。该研究成果于2022年4月28日以Systematic evaluation of colorectal cancer organoid system by single-cell RNA-Seq analysis为题在线发表在Genome Biology上。
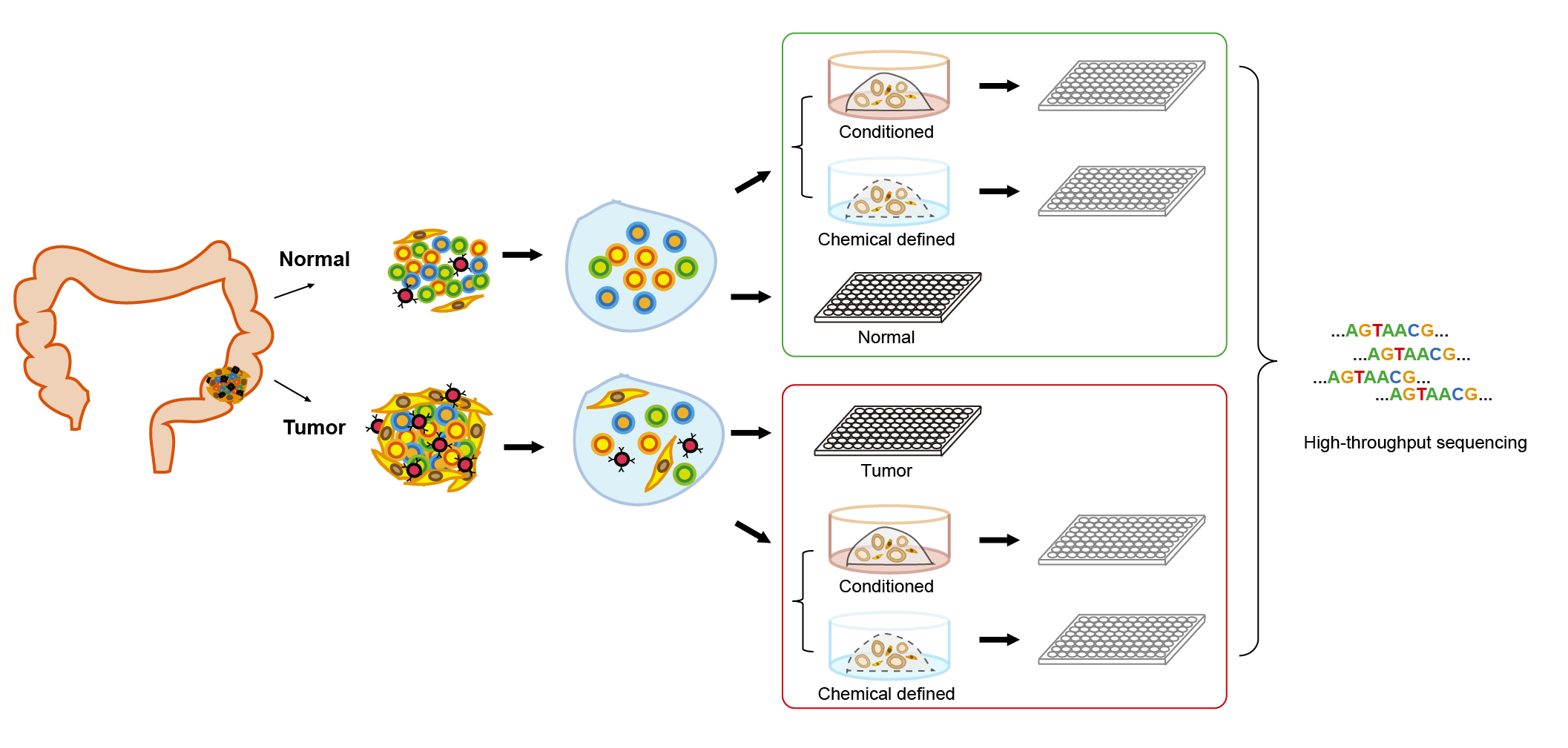
图1 实验设计方案示意图
该研究有以下3个主要发现:
1 肿瘤组织来源的类器官能准确反映对应体内肿瘤上皮细胞(癌细胞)在基因表达、基因突变以及DNA甲基化等方面的关键特征。
通过探索体内肿瘤特异性基因表达模式,该研究发现肿瘤来源的类器官高表达体内肿瘤上皮细胞(癌细胞)特异性表达的基因。并且,肿瘤组织来源的类器官也维持了体内肿瘤上皮细胞特异性的基因调控网络特征。另外,通过对全基因组(WGS)、全外显子组(WES)、以及DNA甲基化组(PBAT)数据进行分析,该研究发现肿瘤类器官能非常好地维持体内肿瘤上皮细胞(癌细胞)在基因突变和DNA甲基化等方面的关键特征(图2)。这表明现有培养体系中的结直肠癌肿瘤类器官非常好地维持了对应患者体内癌细胞的关键生物学特征,因而使用肿瘤类器官筛选的癌症治疗候选药物应该对对应患者体内的癌细胞也会有类似的杀伤效果。现有的肿瘤类器官是肿瘤杀伤药物筛选的优秀平台。
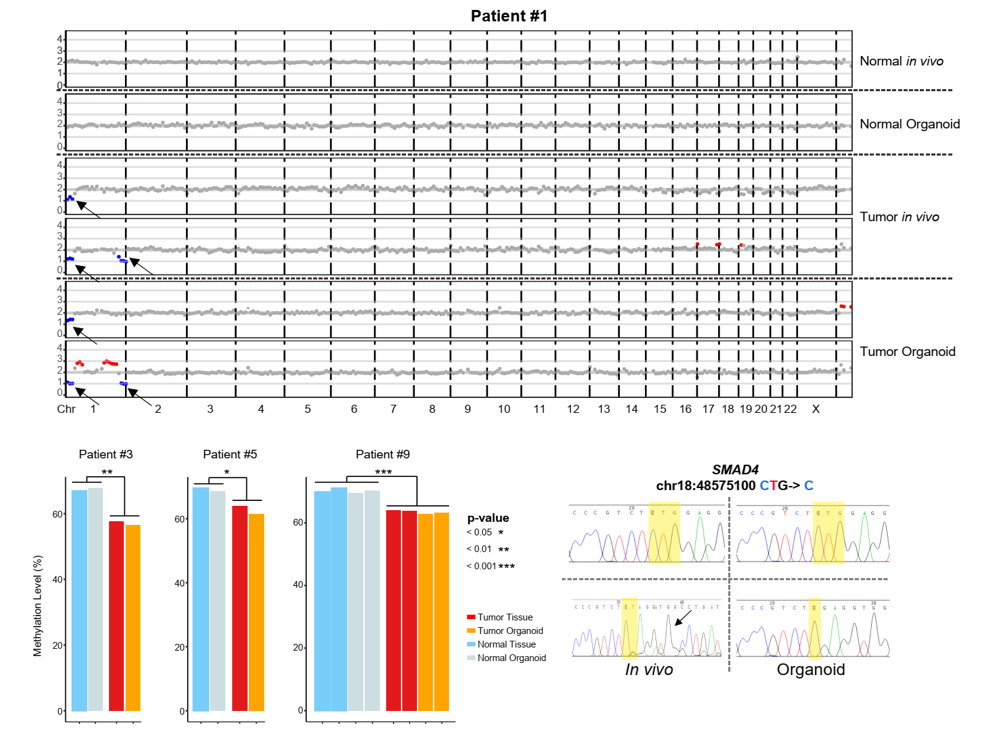
图2. 体内外肿瘤细胞和正常肠上皮细胞的基因组拷贝数变异、DNA甲基化以及基因突变的比较
2 癌旁正常组织来源的类器官在转录组水平上表现出部分肿瘤样特征,但保持正常的基因组和全局DNA甲基化组特征。
首先该研究鉴定了体内肿瘤上皮细胞和癌旁正常肠上皮细胞的差异表达基因,并研究了这些差异基因在体外肿瘤类器官和正常肠上皮类器官的表达情况。结果显示体外正常肠上皮类器官和肿瘤类器官均高表达体内肿瘤上皮细胞特异性表达的基因。
为了进一步验证此结果,该研究对体内组织和体外类器官进行了肿瘤特异性表达基因CEACAM6的免疫荧光染色。与单细胞转录组数据一致,CEACAM6仅在体内肿瘤上皮细胞中高表达,而在体内癌旁正常肠上皮细胞中则不表达。然而,体外培养的肿瘤类器官和正常肠上皮类器官均高表达CEACAM6蛋白,此结果与单细胞转录组测序结果一致(图3)。该研究的癌旁正常组织都取自距离肿瘤组织边缘至少10厘米以外的区域,其正常组织内部混杂大量肿瘤细胞的可能性非常低,但为了进一步排除正常组织类器官有可能是混杂在癌旁正常组织中的肿瘤细胞体外扩增而导致这一现象。
该研究进一步探究了体外肿瘤类器官和正常肠上皮类器官的基因突变和基因组拷贝数变异情况。结果显示只有肿瘤类器官呈现与对应患者体内肿瘤细胞相似的基因组拷贝数变异和基因突变,而正常肠上皮类器官的基因组与体内正常肠上皮细胞一致,没有肿瘤细胞特异性的基因突变和基因组拷贝数变异,从而排除了正常组织类器官起源于癌旁正常组织中混杂部分肿瘤上皮细胞的可能性。
这些数据显示在转录组和蛋白水平上,肿瘤上皮类器官和正常肠上皮类器官都表现出肿瘤样特征。这表明现有的培养体系使得正常肠上皮类器官也具有部分肿瘤细胞特征,因而用同一个患者得到的肿瘤类器官和癌旁正常肠上皮类器官进行配对药物筛选、以筛选出特异性对肿瘤细胞有选择性杀伤效果(杀伤肿瘤类器官,但是不杀伤正常肠上皮类器官)的候选药物目前是无法实现的。
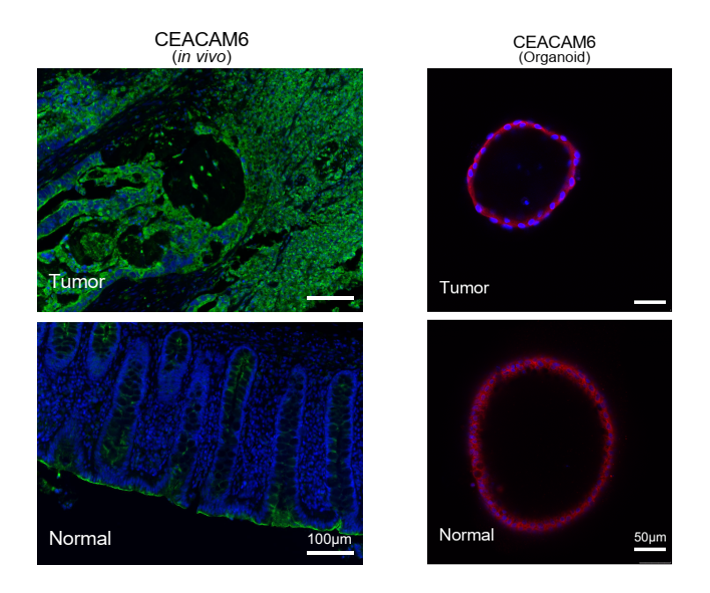
图3. CEACAM6免疫染色荧光结果
3 条件培养基在肿瘤类器官的长期培养方面优于化学成分确定培养基(分子培养基)。
首先,该研究通过MKI67的表达情况对不同培养基中的细胞增殖情况进行了评估(图4)。在化学成分确定培养基(分子培养基)中,正常组织来源的类器官相比肿瘤来源的类器官具有更快的细胞增殖速度。而在条件培养基中,正常组织来源的类器官和肿瘤来源的类器官的细胞增殖速度相当。这说明化学成分确定培养基(分子培养基)更有利于正常肠上皮细胞的生长,而条件培养基对正常肠上皮细胞和肿瘤上皮细胞(癌细胞)的生长没有明显偏好性。而这一特点通过线粒体突变在不同培养基中培养的癌细胞的谱系追踪得到了进一步验证。
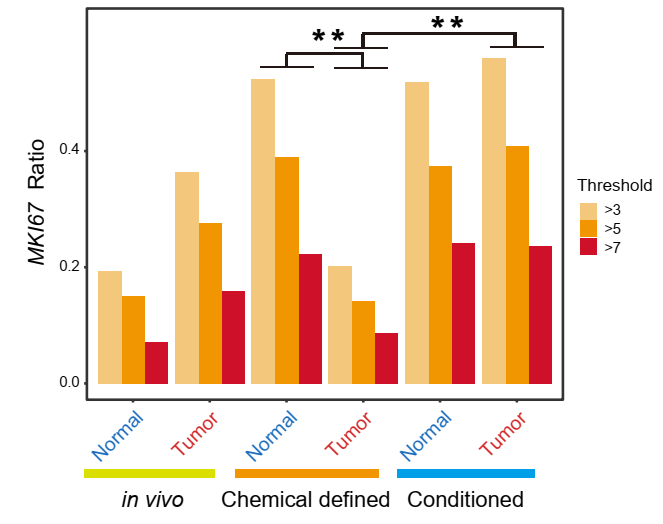
图4. 体内组织以及体外两种培养基中的类器官细胞表达MKI67的比例
此外,该研究结果表明,条件培养基比化学成分确定培养基(分子培养基)更能真实地反映对应体内肿瘤上皮细胞(癌细胞)与正常肠上皮细胞的差异。与体内相应的癌细胞相似,在条件培养基中培养的肿瘤类器官呈现肠上皮干祖细胞标志基因OLFM4高表达和肠上皮分化成熟标志基因CA2低表达的特征,正常组织类器官呈现相反的OLFM4低表达和CA2高表达的模式(图5)。然而,在化学成分确定培养基(分子培养基)中,无论是正常组织类器官还是肿瘤类器官都具有相似的OLFM4高表达和CA2低表达的模式,无法准确模拟对应体内不同类型上皮细胞基因表达的不同特征。这表明现有的两种培养体系对于维持对应体内肿瘤细胞关键生物学特征都有效,但是条件培养基要优于化学成分确定培养基(分子培养基),因而条件培养基是基于类器官的肿瘤发生分子机制研究和药物筛选的首选培养体系。
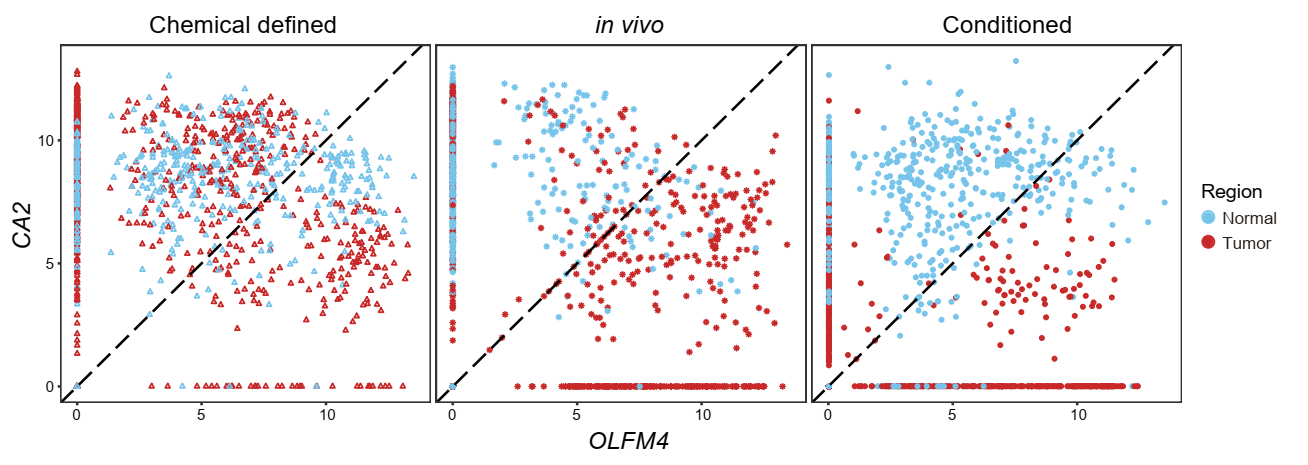
图5. 不同条件下的肿瘤细胞和正常上皮细胞的CA2和OLFM4的表达
综上所述,该项研究对结直肠癌体内肿瘤组织、体内癌旁正常组织、以及配对的在两种不同培养体系中建立的肿瘤类器官、癌旁正常组织类器官进行了高精度单细胞转录组分析,并结合全基因组测序、全外显子组测序、DNA甲基化组测序以及靶位点Sanger 测序的结果,系统评估了类器官模型在研究结直肠癌肿瘤发生分子机制上的可靠性和局限性。该研究发现现有的培养体系中的肿瘤类器官非常好地维持了对应结直肠癌患者体内癌细胞的关键生物学特征,现有的肿瘤类器官是肿瘤发生分子机制研究以及肿瘤杀伤药物筛选的优越平台。现有的培养体系使得正常肠上皮类器官也具有部分肿瘤细胞特征,因而无法用同一个患者得到的肿瘤类器官和正常肠上皮类器官进行配对筛选,以便得到对肿瘤细胞有选择性杀伤效果的候选药物。现有的两种培养体系对于维持结直肠癌肿瘤细胞关键生物学特征都有效,但是条件培养基要优于化学成分确定培养基(分子培养基),因而条件培养基是结直肠癌肿瘤发生分子机制研究和药物筛选的首选培养体系。
北京大学博士后汪睿、博士生毛雨诺、王维以及北京大学第三医院普通外科周鑫主治医生、王文东博士为该论文的并列第一作者。北京大学生物医学前沿创新中心汤富酬教授和北京大学第三医院普通外科付卫教授为该论文的共同通讯作者。该研究项目得到了国家自然科学基金和北京未来基因诊断高精尖创新中心(ICG)的支持。
论文链接:
https://genomebiology.biomedcentral.com/articles/10.1186/s13059-022-02673-3



