原发性皮肤T细胞淋巴瘤 (Cutaneous T cell lymphoma, CTCL) 是一类皮肤归巢T细胞起源的恶性肿瘤,发病率占结外非何杰金淋巴瘤第二位【1】。晚期CTCL患者系统化疗效果持续时间短,患者预后很差,需要新的治疗手段【2】。PD-1 (Programmed Cell Death Protein 1, PD-1) 是T细胞衰竭过程中的关键共抑制受体。阻断PD-1与配体PD-L1结合的抗体药物可以逆转抗肿瘤T细胞的耗竭状态,增强T细胞的增殖和抗肿瘤免疫功能。10年来,临床试验已经表明PD-1单抗在多种肿瘤类型中具有较强的抗肿瘤活性。临床实验证实,针对PD-1的免疫检查点阻断治疗在CTCL患者中有15-38%的有效率,提示该治疗方法对CTCL患者是一项有前景的治疗手段【3, 4】。然而,于此同时,也有25-31%的CTCL病人在应用抗PD-1单抗治疗后发生进展【3, 4】。因此,非常有必要揭示PD-1单抗导致CTCL进展的机制以提高针对PD-1的免疫检查点阻断治疗的有效性与安全性。
近日,北京大学第一医院皮肤科汪旸教授课题组联合北京大学生物医学前沿创新中心白凡教授课题组合作在JCI Insight上发表了题为Hyperprogression of cutaneous T cell lymphoma after anti-PD-1 treatment的研究成果,该研究从单细胞水平阐释了PD-1单抗导致CTCL进展的机制,利用真实世界的证据证明PD-1在具有致癌性TCR通路激活的恶性T细胞中是重要的肿瘤抑制因子。

一名血液显著受累的晚期CTCL患者在应用首次低剂量PD-1单抗后出现了淋巴瘤的超进展。为区分肿瘤性T细胞及非肿瘤性T细胞对PD-1单抗的不同反应,该团队利用单细胞RNA测序对该患者抗PD-1治疗前后的原代PBMC进行了检测,并利用功能实验进行验证。单细胞RNA测序发现PD-1单抗导致肿瘤性T细胞的显著增殖和活化,而非肿瘤性CD8+T细胞的基因表达谱无显著改变。进一步分析发现,该患者肿瘤细胞表达PD-1,且功能实验证实PD-1通路活化可以显著抑制原代肿瘤性T细胞的增殖;PD-1单抗解除了PD-1通路对下游信号通路的抑制作用。
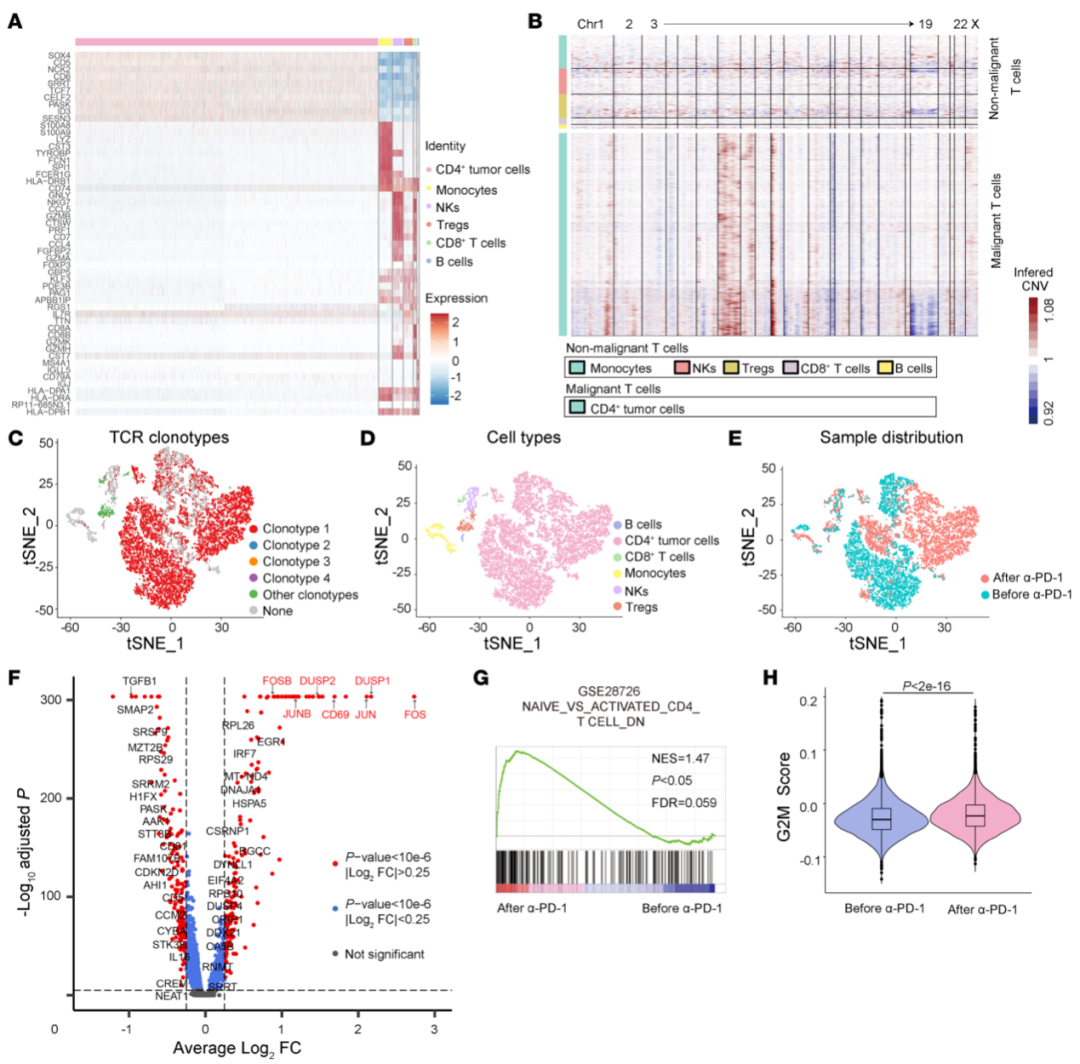
图2 PD-1单抗促进淋巴瘤细胞的活化和增殖
在正常T细胞中,PD-1通路对T细胞增殖的抑制作用依赖TCR通路的活化。全基因组测序发现该患者肿瘤性T细胞中存在PRKCQ基因的显著扩增。PRKCQ编码PKCθ,既往研究证实PKCθ在TCR/NF-kB通路中发挥关键作用,PKCθ在第538位苏氨酸的磷酸化是其活化的标志。该研究分析发现PRKCQ扩增导致PKCθ和p-PKCθ (T538) 在恶性T细胞上高表达,导致TCR信号通路的致癌性激活。PD-1单抗解除了PD-1通路对致癌性TCR通路的抑制作用,促进了肿瘤性T细胞的增殖和活化,从而导致CTCL的超进展。
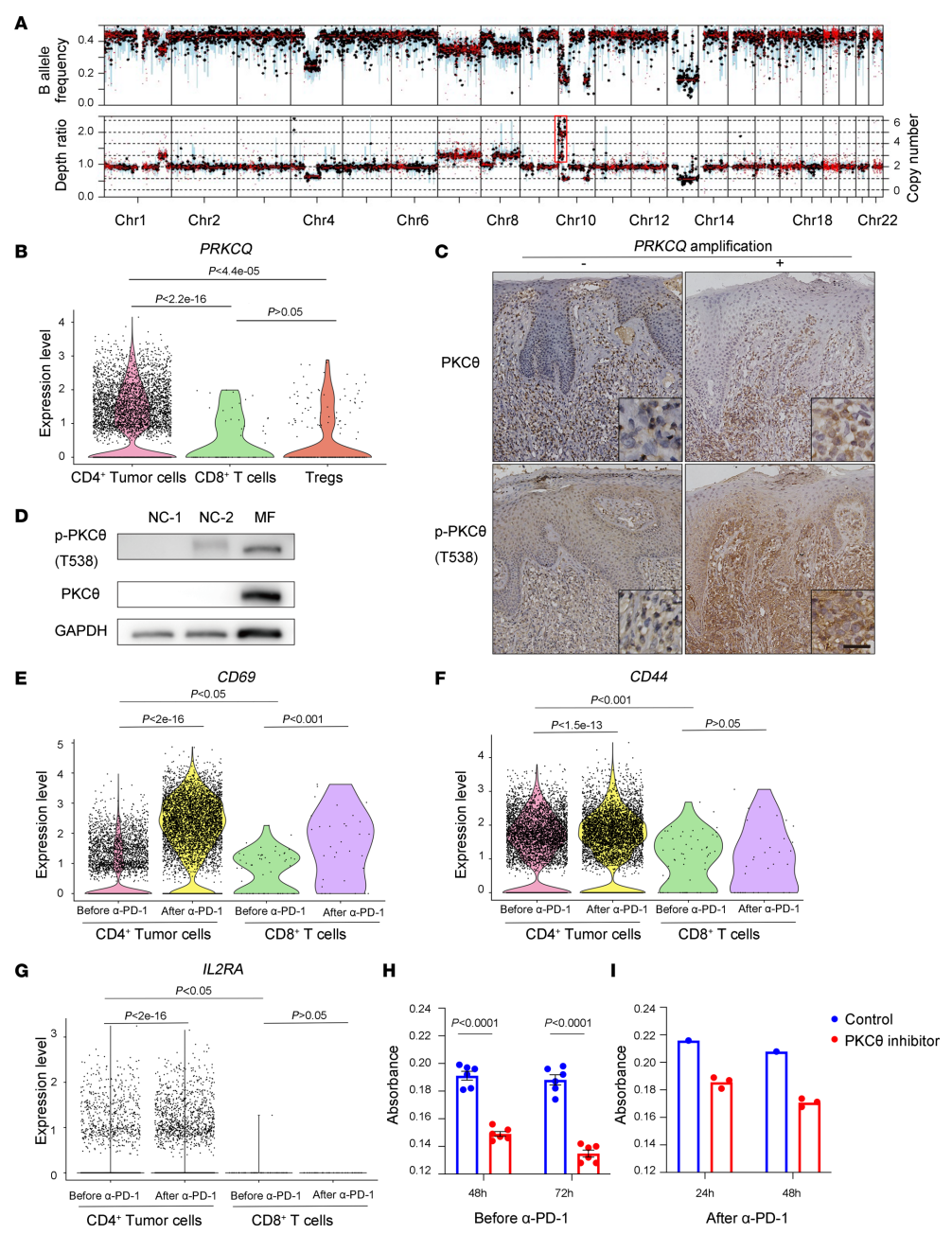
图3. PRKCQ的扩增导致淋巴瘤细胞中TCR信号通路的组成性活化
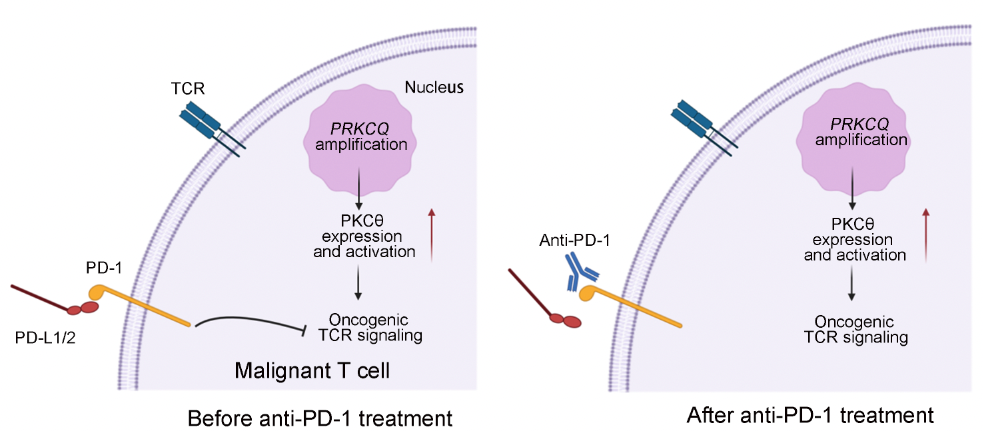
图4. PD-1单抗导致CTCL超进展的机制示意图
综上所述,该工作利用真实世界的临床证据证明PD-1在具有致癌性TCR通路激活的恶性T细胞中是重要的肿瘤抑制因子。TCR通路相关分子的遗传学改变是CTCL肿瘤细胞的显著特征【5】;19%-39.4% CTCL患者的肿瘤性T细胞同样表达PD-1 【6, 7】。这些结果提示,肿瘤基因组分析有助于提高T细胞淋巴瘤患者在抗PD-1/PD-L1治疗中的临床获益。
北京大学第一医院皮肤科汪旸教授和北京大学生物医学前沿创新中心白凡教授为本研究论文的共同通讯作者,北京大学第一医院高玉梅博士和北京大学胡思梦博士生为论文共同第一作者。(来源:BioArtMED微信公众号)
原文链接:
https://pubmed.ncbi.nlm.nih.gov/36649072/
参考文献
1. Criscione VD, and Weinstock MA. Incidence of cutaneous T-cell lymphoma in the United States, 1973-2002. Archives of dermatology. 2007;143(7):854-9.
2. Hughes CF, Khot A, McCormack C, Lade S, Westerman DA, Twigger R, et al. Lack of durable disease control with chemotherapy for mycosis fungoides and Sézary syndrome: a comparative study of systemic therapy. Blood. 2015;125(1):71-81.
3. Khodadoust MS, Rook AH, Porcu P, Foss F, Moskowitz AJ, Shustov A, et al. Pembrolizumab in Relapsed and Refractory Mycosis Fungoides and Sézary Syndrome: A Multicenter Phase II Study. J Clin Oncol. 2020;38(1):20-8.
4. Lesokhin AM, Ansell SM, Armand P, Scott EC, Halwani A, Gutierrez M, et al. Nivolumab in Patients With Relapsed or Refractory Hematologic Malignancy: Preliminary Results of a Phase Ib Study. J Clin Oncol. 2016;34(23):2698-704.
5. Dummer R, Vermeer MH, Scarisbrick JJ, Kim YH, Stonesifer C, Tensen CP, et al. Cutaneous T cell lymphoma. Nature reviews Disease primers. 2021;7(1):61.
6. Gao Y, Liu F, Sun J, Wen Y, Tu P, Kadin ME, et al. Differential SATB1 Expression Reveals Heterogeneity of Cutaneous T-Cell Lymphoma. The Journal of investigative dermatology. 2021;141(3):607-18 e6.
7. Cetinozman F, Jansen PM, Vermeer MH, and Willemze R. Differential expression of programmed death-1 (PD-1) in Sezary syndrome and mycosis fungoides. Archives of dermatology. 2012;148(12):1379-85.



