线粒体作为细胞的"能量中心"在细胞生命活动过程中扮演着重要角色,它还是细胞核外存储遗传信息的另一细胞器。据MITOMAP数据库统计,在已确认的97种线粒体遗传疾病中,93种由点突变引起,因此使用碱基编辑工具修正这些突变具有重要意义。然而线粒体中的电子传递将质子从线粒体基质排出,使得基质带有强负电荷,这阻碍了具有相同负电荷核酸(如CRISPR系统的sgRNA)的进入1。全蛋白基础的基因编辑工具ZFN和TALEN可以在定位信号的引导下进入线粒体,之前有研究报道在小鼠线粒体中可以据此靶向敲低突变的基因组2,3。然而,敲低线粒体基因组不能治疗纯合的线粒体突变,也不能主动改变线粒体基因组的碱基构成。
基于CRISPR-Cas系统开发的单碱基编辑在治疗基因组点突变引起的遗传疾病方面显示出巨大潜力。碱基编辑器中使用的脱氨酶都是单链DNA脱氨酶,在Cas9和sgRNA的作用下,目标DNA双链中的非靶向链暴露出来,为单链DNA脱氨酶实现有效碱基转换提供了必要条件4。与CRISPR-Cas系统相比,锌指蛋白(ZF)和转录激活因子样效应子(TALE)只具有结合DNA双链的活性,却无法解开DNA双链5。因此,简单将单链DNA脱氨酶与ZF或TALE结合无法实现对DNA的有效碱基编辑6。
2020年,Joseph Mougous实验室和David Liu实验室利用一种能够作用于双链DNA的脱氨酶DddA开发出了线粒体单碱基编辑器,首次实现了线粒体基因C->T的碱基编辑7。2022年Jin-Soo Kim实验室使用DddA和TadA8e组合,进一步实现了线粒体基因组A->G的碱基编辑8。然而,左二伟实验室和伊成器实验室随后发现DddA系统存在比较严重的脱靶效应9,10,特别是DddA与CTCF存在相互作用,会产生细胞核基因组的非特异性编辑10。
2023年5月22日,北京大学生物医学前沿创新中心(BIOPIC)魏文胜课题组在Nature Biotechnology杂志在线发表题为 Strand-selective base editing of human mitochondrial DNA using mitoBEs的研究论文,报道了一种名为mitoBEs的全新线粒体单碱基编辑工具,该工具不依赖于DddA系统。mitoBEs不仅能够高效地实现A->G或C->T的单碱基编辑,还具备选择性地编辑特定链的能力,这是DddA系统所不具备的。此外,研究人员未观察到明显的脱靶现象。
由于目前发现的除DddA之外的DNA脱氨酶,都只能作用于单链DNA,整个研究基于这样的假设:在靶向位点产生瞬时的单链DNA,可以为所有“普通” 脱氨酶提供有效反应底物。因此,在TALE系统提供靶向的基础上,研究者整合了切口酶(nickase)和脱氨酶(deaminase),成功建立了高效的TALE版本的单碱基编辑器,实现了线粒体基因组的碱基编辑(mitochondrial DNA base editors, mitoBEs)。使用含有线粒体定位信号的TALE-MutH和TALE-TadA8e(V106W)靶向线粒体基因组,可以实现有效的A->G编辑(图1)。对切口酶MutH的突变研究,可以大幅度突破其序列偏好,将可编辑范围提高10倍以上。此外,无识别序列偏好的切口酶Nt.BspD6I(C)和FokI-FokI(D450A),也能够有效应用于mitoBEs系统(图2)。
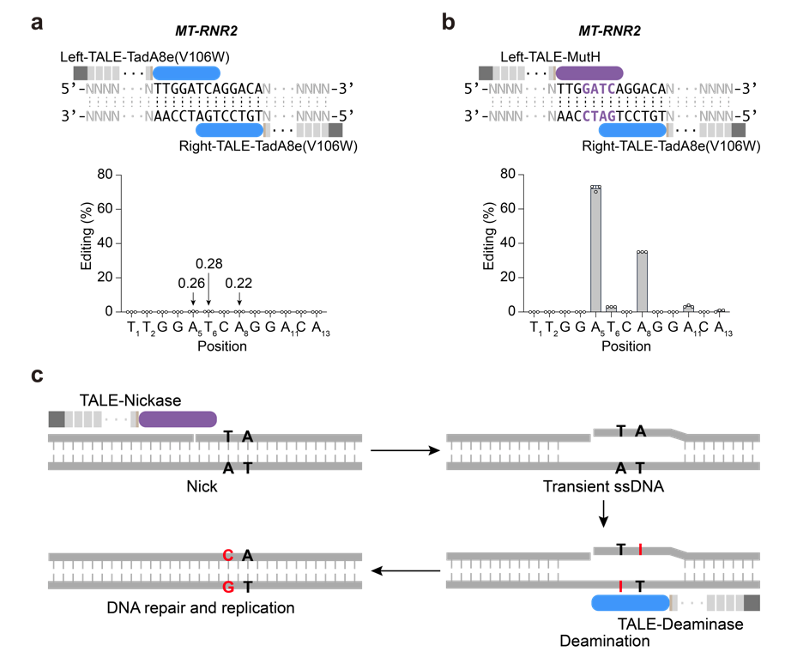
图1: 引入nickase来实现链选择性DNA编辑及mitoBE工作模型
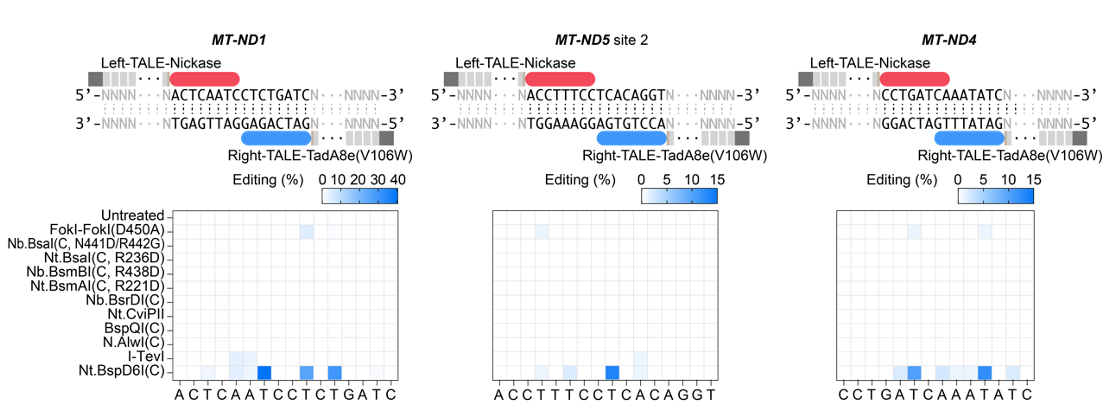
图2: 筛选可以用于mitoBE系统的无识别序列限制的nickase
除了A->G方向的编辑,TALE-MutH和TALE-rAPOBEC1-2×UGI的结合可以实现C->T的高效碱基转换。与DdCBE相比,mitoBEs具有链选择性偏好。此外,通过全基因组测序,mitoBEs在线粒体和细胞核中都没有检测到严重的脱靶编辑,证明其具有高度特异性和安全性。
研究者进一步尝试这一新型编辑器在疾病治疗中的应用。Leber遗传性视神经病变 (Leber's hereditary optic neuropathy, LHON) 是一种由线粒体基因突变引起的急性眼部疾病,患者均为成年人。研究者利用环状RNA编码的mitoBEs实现了高效线粒体DNA链选择性碱基编辑,成功建立了疾病模型。随后,针对LHON患者来源的细胞,使用环状RNA编码的mitoBEs在目标位点实现了约20%的编辑效率,修复后的细胞具有更高的ATP含量和氧化呼吸水平,表明mitoBEs对线粒体遗传疾病具有治疗潜力。这是首次通过碱基编辑方式修正了线粒体的致病突变(图3)。由于理论上这一新技术能够修正大多数线粒体疾病突变(图3),这就为治疗这些危害重大的疾病提供了有希望的治疗方法。此外,该技术方案也适用于细胞核基因组的碱基编辑,对相关疾病治疗提供了潜力巨大的新工具。
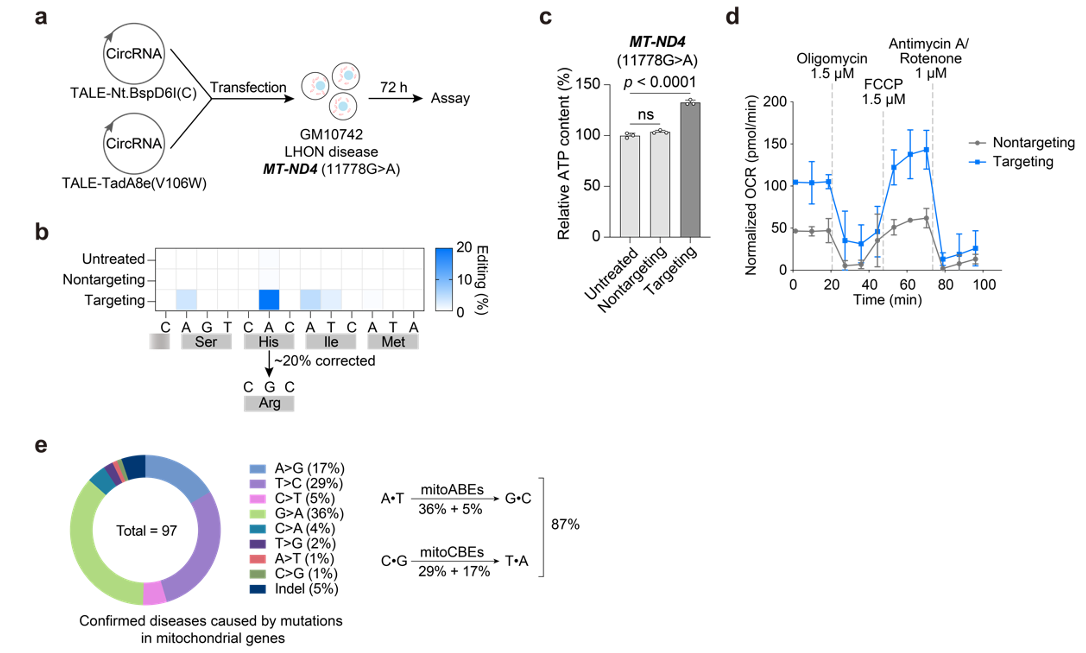
图3: 使用mitoBE纠正LHON病人来源细胞的线粒体基因突变
北京大学魏文胜课题组博士后伊宗裔、博士研究生张小雪为论文的共同第一作者,北京大学魏文胜教授为论文的通讯作者,唐玮、于莹、魏晓旭和张雪对文章也作出了重要贡献。该研究项目得到了国家重点研发计划、国家自然科学基金重点项目、北京市科委生物医学前沿创新推进项目、北大-清华生命科学联合中心、昌平实验室和中国博士后科学基金的支持。
文章链接: https://doi.org/10.1038/s41587-023-01791-y
参考文献:
1 Gammage, P. A., Moraes, C. T. & Minczuk, M. Mitochondrial Genome Engineering: The Revolution May Not Be CRISPR-Ized. Trends Genet34, 101-110, doi:10.1016/j.tig.2017.11.001 (2018).
2 Bacman, S. R. et al. MitoTALEN reduces mutant mtDNA load and restores tRNA(Ala) levels in a mouse model of heteroplasmic mtDNA mutation. Nat Med24, 1696-1700, doi:10.1038/s41591-018-0166-8 (2018).
3 Gammage, P. A. et al. Genome editing in mitochondria corrects a pathogenic mtDNA mutation in vivo. Nat Med24, 1691-1695, doi:10.1038/s41591-018-0165-9 (2018).
4 Anzalone, A. V., Koblan, L. W. & Liu, D. R. Genome editing with CRISPR-Cas nucleases, base editors, transposases and prime editors. Nat Biotechnol38, 824-844, doi:10.1038/s41587-020-0561-9 (2020).
5 Deng, D. et al. Structural basis for sequence-specific recognition of DNA by TAL effectors. Science335, 720-723, doi:10.1126/science.1215670 (2012).
6 Yang, L. et al. Engineering and optimising deaminase fusions for genome editing. Nat Commun7, 13330, doi:10.1038/ncomms13330 (2016).
7 Mok, B. Y. et al. A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. Nature583, 631-637, doi:10.1038/s41586-020-2477-4 (2020).
8 Cho, S. I. et al. Targeted A-to-G base editing in human mitochondrial DNA with programmable deaminases. Cell185, 1764-1776 e1712, doi:10.1016/j.cell.2022.03.039 (2022).
9 Wei, Y. et al. Mitochondrial base editor DdCBE causes substantial DNA off-target editing in nuclear genome of embryos. Cell Discov8, 27, doi:10.1038/s41421-022-00391-5 (2022).
10 Lei, Z. et al. Mitochondrial base editor induces substantial nuclear off-target mutations. Nature606, 804-811, doi:10.1038/s41586-022-04836-5 (2022).



