
高级别浆液性卵巢癌(HGSOC)是最常见的卵巢癌病理亚型,75%以上的患者首诊时已是晚期,常伴有广泛的网膜转移和腹水产生[1]。此外,免疫检查点阻断等免疫治疗手段仅在10%左右的卵巢癌病人中起效。研究表明,卵巢癌腹水中的成纤维细胞亚群可以通过激活肿瘤细胞中的JAK/STAT通路以影响患者的预后及其对免疫治疗的响应[2]。然而,卵巢癌腹水环境中的其它细胞类群对其肿瘤微环境的影响方式和途径仍不明确。
2023年7月24日,北京大学生物医学前沿创新中心(BIOPIC)张泽民团队与上海交通大学医学院附属新华医院汪希鹏团队,以及上海交通大学医学院上海市免疫学研究所博士后李子逸合作在Nature Cancer 期刊在线发表了题为Single-cell analyses implicate ascites in remodeling the ecosystems of primary and metastatic tumors in ovarian cancer的研究论文。该研究指出了卵巢癌腹水中的记忆T细胞是肿瘤原发灶及转移灶中终末态T细胞的重要补充池,并揭示了肿瘤组织及腹水中巨噬细胞功能表型和起源的异质性,为深入理解卵巢癌腹水对肿瘤进展的影响以及后续进一步探索靶向肿瘤腹水的免疫治疗策略提供了重要的理论依据。

研究团队收集了来自14例卵巢癌患者的包括原发灶、转移灶、腹水、外周血以及盆腔淋巴结在内5个部位共39个样本,并对所有样本进行了单细胞转录组测序和T细胞受体(TCR)测序。通过分析不同部位样本内T细胞类群的组成情况,研究人员首先发现在实体肿瘤组织中主要富集耗竭T细胞(Tex)及调节性T细胞(Treg)等免疫抑制型T细胞,而腹水中富集的则多为效应T细胞(Teff)和记忆T细胞(Tcm/Tem)。尽管在所有的腹水样本中均可以检测到肿瘤细胞的存在,但该结果表明,腹水微环境并未呈现出肿瘤内部的强烈免疫抑制性状态。
为了进一步探索肿瘤和腹水中T细胞类群的发育关系,研究人员以TCR作为标签,使用STARTRAC算法[3]对本研究中鉴定出的10种不同类型T细胞进行追踪和定量分析,发现肿瘤组织中浸润的Tex细胞与腹水中富集的CD8+GZMK+ Tem之间存在高度TCR共享。进一步分析发现,相较于原发灶,腹水中的Tem细胞更倾向与转移灶中的Tex细胞共享TCR。此外,肿瘤中Tex细胞与腹水中Tem细胞之间的联系(Tex-Tem in ascites)与其与肿瘤中Tem细胞之间的联系(Tex-Tem in tumor)是互相排斥的(mutually exclusive)。由于终末分化Tex细胞具有不可逆转的细胞状态和较差的组织迁移能力,因此,以上结果提示腹水中的CD8+GZMK+ Tem细胞具有浸润至肿瘤组织中并直接转化为Tex细胞的能力。研究人员在CD4+T细胞的分析中也发现了类似的现象,腹水中的CD4+Tcm与肿瘤组织中的CD4+CXCL13+Th1样细胞同样存在高度TCR共享,揭示其很可能是肿瘤组织中Th1样细胞的前体来源。综合上述分析结果,腹水中富集的记忆T细胞是肿瘤浸润终末状态T细胞极为重要的补充池(pool),揭示了腹水在塑造肿瘤微环境中发挥的关键作用(图1)。
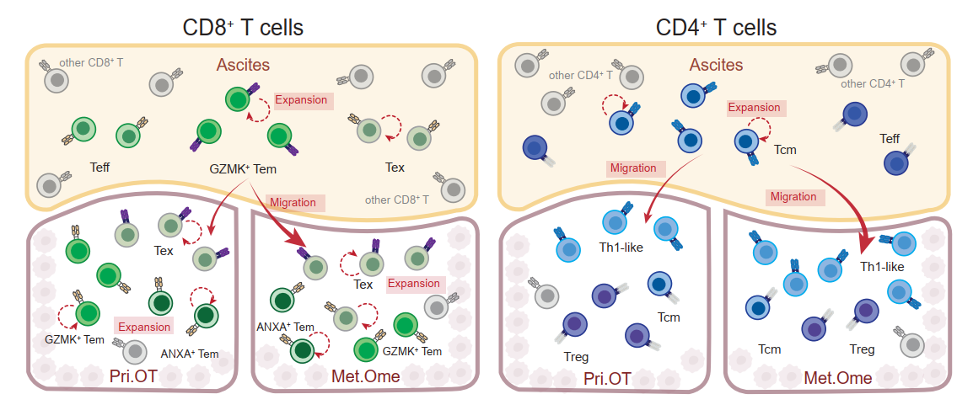
图1:肿瘤和腹水间不同T细胞亚群间的谱系关系
肿瘤相关巨噬细胞(TAM)是肿瘤免疫微环境中不可或缺的部分,承担着重要的免疫调控作用。基于不同的组织来源特征,研究团队首先将巨噬细胞亚群分为肿瘤富集的巨噬细胞(tumor-enriched macrophage, TeMac)和腹水富集的巨噬细胞(ascites-enriched macrophage, AeMac)两大类群。通过比较两群巨噬细胞的功能发现,TeMac高表达VEGFA及CCL3、CXCL12等细胞因子,具有较强的T细胞招募能力。AeMac则上调LYVE1及CD163等组织驻留巨噬细胞(resident-tissue macrophage, RTM)的特征基因。考虑到腹水的液体环境,研究人员对肿瘤和腹水中巨噬细胞的来源进一步进行探索。通过比较各巨噬细胞亚群的RTM得分并结合Ms4a3Cre-RosaTdT谱系示踪小鼠模型发现,尽管卵巢癌肿瘤组织中的巨噬细胞主要为单核细胞来源,但仍存在着少量具有较强RTM特征的巨噬细胞(M10)。反之,RTM则是腹水中巨噬细胞的重要来源及主要组成部分。此外,本研究还整合分析了张泽民课题组之前发表的单细胞数据(结直肠癌和肝癌的髓系免疫细胞类群),综合研究发现,尽管不同癌种、不同组织来源的巨噬细胞亚群表现出较强的异质性,但卵巢癌腹水的巨噬细胞亚群M08、M09和M14仍与肝癌腹水的M-C6-MARCO亚群聚为一类。以上结果提示,微环境和发育来源共同影响着巨噬细胞的功能特征(图2) 。
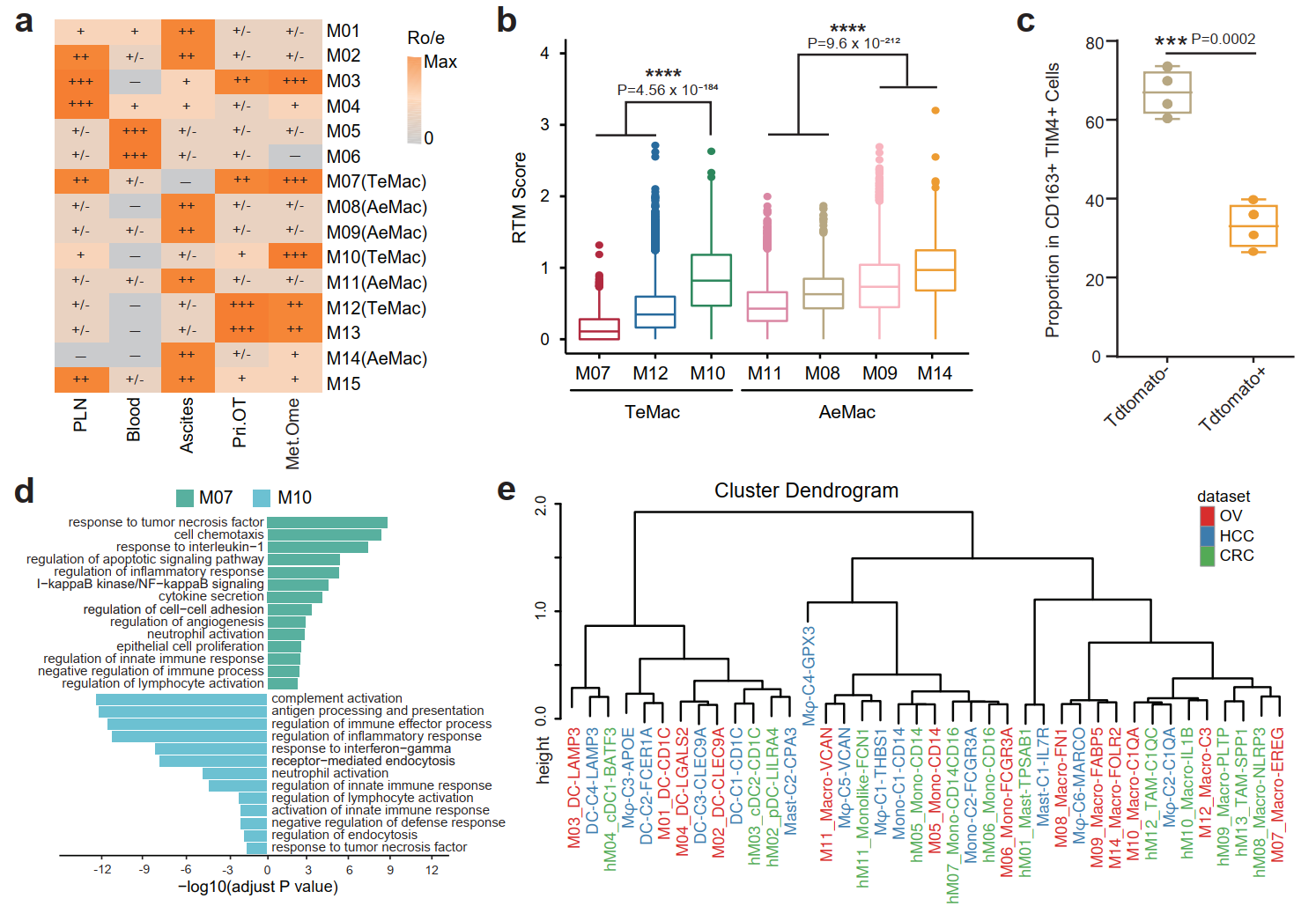
图2:卵巢癌腹水及肿瘤组织微环境中不同功能表型和发育来源的巨噬细胞
卵巢癌患者手术后的基础治疗通常为铂类化疗,本研究涉及的卵巢癌患者有4例为化疗耐药及9例为化疗敏感。研究人员通过比较不同化疗响应情况的患者治疗前样本中细胞亚群的分布情况,发现肿瘤原位灶中VCAM+内皮细胞占比较高的HGSOC患者对化疗敏感,反之,IL13RA1+内皮细胞的富集则提示患者对化疗耐药。此外,腹水中高比例的MAIT细胞(mucosal-associated invariant T cells)和cDC1细胞亦可提示HGSOC患者对化疗的敏感性(图3)。
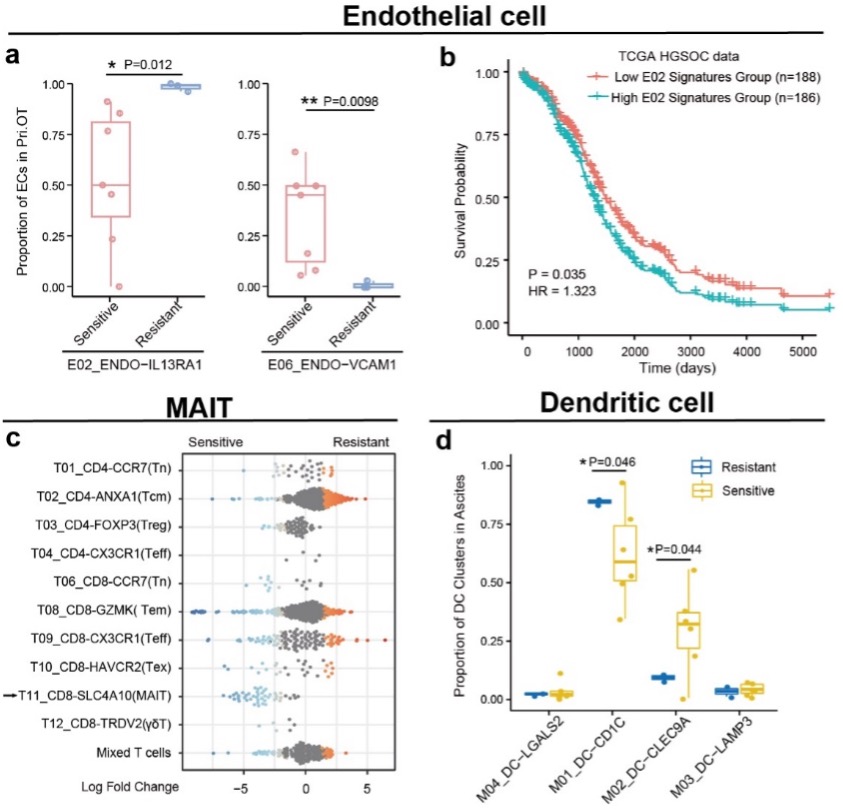
图3:卵巢癌中影响患者对化疗敏感性的细胞类群
综上,该研究构建了涵盖卵巢癌多部位的单细胞图谱,揭示了肿瘤不同部位微环境内细胞类群间的动态变化和调控关系,明确了卵巢癌腹水对肿瘤免疫微环境的塑造作用,同时发现了可用于预测卵巢癌化疗疗效的特定细胞亚型,为卵巢癌的基础研究和临床诊治提供了重要理论依据。
上海交通大学医学院附属新华医院汪希鹏教授,北京大学生物医学前沿创新中心(BIOPIC)张泽民教授以及上海交通大学医学院上海市免疫学研究所博士后李子逸为本文的共同通讯作者。上海交通大学医学院附属新华医院博士研究生郑小翠、王昕婧,复旦大学附属肿瘤医院妇科医师程玺为该论文并列第一作者。张泽民教授参与了本研究的实验设计,并指导了单细胞数据分析的工作。
论文链接:
https://www.nature.com/articles/s43018-023-00599-8
参考文献:
1.Lheureux, S., et al., Epithelial ovarian cancer. Lancet, 2019. 393(10177): p. 1240-1253.
2.Izar, B., et al., A single-cell landscape of high-grade serous ovarian cancer. Nat Med, 2020. 26(8): p. 1271-1279.
3. Bian, Z., et al., Deciphering human macrophage development at single-cell resolution. Nature, 2020. 582(7813): p. 571-576.



