2025年3月4日,国家中心、北大血研所黄晓军院士&刘江莹研究员联合北大BIOPIC高歌教授团队,在 cellular & molecular immunology上发表题为Systematic mining and quantification reveal the dominant contribution of non-HLA variations to acute graft-versus-host disease的研究论文,首次量化揭示非HLA遗传因素在aGVHD中的重要作用。

一分钟秒懂要点:
1. 本研究首次系统分析了HLA单倍型相合造血细胞移植(haploHCT)供、受者移植前的遗传变异,发现了一系列非HLA基因功能缺失性(Loss of function, LoF)变异(包括供者或受者基因LoF变异和供-受者基因对同时存在LoF变异)与移植后发生aGVHD显著相关。
2. 首次建立了涵盖HLA配型、非HLA遗传变异以及相关临床因素的aGVHD风险量化评估机器学习模型,揭示了非HLA遗传变异对haploHCT 后发生aGVHD的贡献最大,该模型的可靠性在另一个独立的HLA同胞相合移植队列中得到了验证。
3. 对代表性LoF基因进行功能实验,证实了非HLA LoF变异基因可显著影响人原代T细胞的同种反应性。
4. 文章以Article形式在线发表于Cellular & Molecular Immunology杂志。
研究方法:
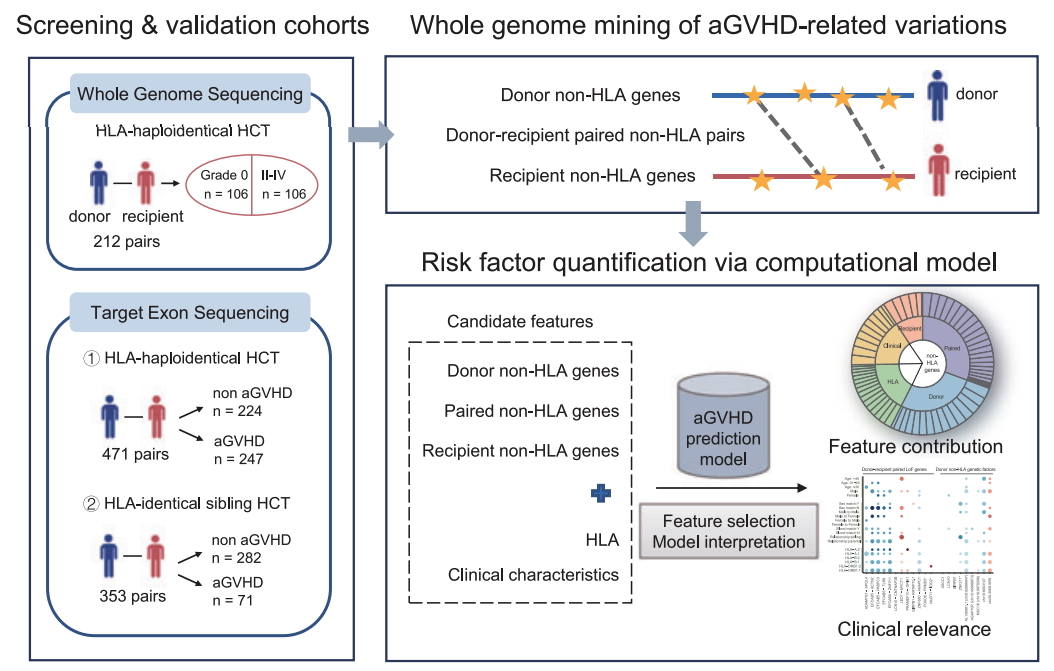
本研究首先对212对haploHCT供/受者(II-IV 度aGVHD和未发生aGVHD各106对)移植前外周血DNA样本进行了全基因组测序(WGS),在全基因组层面系统分析aGVHD相关遗传变异,重点关注LoF变异基因及供/受者LoF基因对;根据筛选结果选择代表性LoF变异基因,利用外显子捕获测序技术在包括471对供/受者的haploHCT延续队列和另一个独立的353对HLA全相合HCT队列(分别作为验证队列)中进行aGVHD相关性验证;在此基础上,采用机器学习方法将非HLA遗传变异与HLA配型及临床因素相结合,构建aGVHD 风险因素定量评估模型,量化揭示各因素对aGVHD的贡献;利用CRISPR/Cas9方法敲除代表性非HLA LoF基因,证实其对T细胞同种反应性的影响。
研究结果:
aGVHD 相关非 HLA LoF变异基因的鉴定及验证
通过WGS分析了424例 供/受者haploHCT移植前的DNA样本,发现了640对非HLA LoF变异基因对(即供者A基因和受者B基因同时存在LoF变异)与移植后发生aGVHD显著相关,且该相关性独立于HLA配型不合;从显著相关的LoF基因对中选定93个代表性基因,利用外显子捕获技术对不同验证队列样本进行测序,在haploHCT验证队列(n ="471)中验证了27个LoF基因对与aGVHD显著相关,在H" LA同胞相合验证队列(n ="353)中验证了35个LoF基因对与aGVHD显著相关。
aGVHD 风险因素量化评估模型的建立及验证
首先进行了基于支持向量机(SVM)模型的特征筛选,共筛选出包括HLA和非HLA遗传因素、以及一临床信息(供/受者年龄、性别等)在内的50个关键特征,用于构建aGVHD风险定量评估模型;在基于 haploHCT数据集构建的模型中,非HLA遗传特征的贡献最大高达66%(其中LoF基因对贡献约占30%),而HLA因素仅占比23%;进而在HLA同胞相合验证队列中得到了相似结论(非 HLA 遗传特征贡献占比达 67%,其中LoF基因对贡献约占31%)。上述结果表明,本研究建立的量化评估模型在不同异基因移植队列中具有高度的一致性,凸显了非HLA遗传因素在aGVHD发生发展中的重要作用。
非HLA LoF基因在T细胞同种异体反应中的功能验证
选择了代表性LoF变异基因对(供者EFCAB5和受者FRMD5),在人原代T细胞中利用CRISPR/Cas9方法敲减EFCAB5基因,可显著降低其产生促炎细胞因子能力;在混合淋巴细胞培养体系中同时敲减应答细胞中的EFCAB5基因和刺激细胞中的FRMD5基因,可进一步降低促炎细胞因子分泌水平,证明了该LoF基因对在同种异体反应中的协同保护效应。
研究者解析:
aGVHD是导致移植后早期非复发死亡的主要并发症,尽管过去数十年间针对aGVHD的临床诊疗方案一直在不断改进,但如何降低异基因造血细胞移植后aGVHD的发生率仍是亟需解决的重要临床问题。揭示影响aGVHD发生发展的因素、阐明其作用机制是aGVHD防治的关键所在。既往研究已报道了诸多临床因素(包括预处理方案、供者年龄和性别等)与aGVHD存在显著相关性。而对于aGVHD的遗传风险因素,现有文献主要集中在HLA及次要组织相容性抗原是否匹配,虽然也有研究报道了一些非HLA基因(如细胞因子基因等)的单核苷酸多态性与移植后发生GVHD相关,但缺乏对不同遗传变异表型的全景式筛选以及相关遗传因素的功能证据。非HLA基因LoF变异尚未被纳入aGVHD遗传风险研究体系。 本研究全面评估了HLA和非HLA遗传因素、以及相关临床特征对发生aGVHD的影响,首次定量揭示了非HLA遗传因素在aGVHD中的主要贡献,挑战了异基因移植领域传统的HLA中心视角。上述发现不仅揭示了非HLA基因LoF变异在aGVHD中的重要作用,同时提出了从遗传学角度探索调节T细胞同种反应性的新机制,突破了传统免疫调控基因的研究框架,开辟了aGVHD机制研究的全新路径。 现有移植供者筛选和aGVHD风险评估体系多依赖临床因素和HLA配型,本研究结果为上述目的提供了新的标志物。将相关非HLA LoF基因作为变量纳入评估体系,建立新的aGVHD风险预测模型,可能推动临床供者筛选和aGVHD风险评估策略的改进,具有重要临床转化意义。
国家血液系统疾病临床医学研究中心、北京大学血液病研究所黄晓军院士,北京大学生物医学前沿创新中心、北京大学生命科学学院生物信息学中心高歌教授,与国家血液系统疾病临床医学研究中心、北京大学血液病研究所刘江莹研究员为该论文的共同通讯作者。国家血液系统疾病临床医学研究中心博士生梁爽 博士(已毕业)与北京大学生物医学前沿创新中心博士后亢雨笺博士(已出站)为该论文的并列第一作者。



