研究图示(来源:Cell)
来源:测序中国
哺乳动物基因组的转录和3D结构在神经发育及其紊乱中都起着至关重要的作用。细胞类型特异性基因表达、染色质结构、感觉体验和其他因素(如表观遗传标记)之间的动态互作是大脑强大可塑性和功能的基础。转录和染色质结构的失调会导致神经发育障碍,如自闭症和精神分裂症。此外,基因组拓扑结构也决定了人类神经元中体细胞DNA损伤和突变的分布。
最近在研究大脑的转录组和3D基因组方面已取得了一些进展,然而仍存在着一些局限性:(1)单个脑细胞的3D基因组结构尚未得到解决,目前虽已在成人大脑中实现了单细胞染色质构象捕获(3C/Hi-C),但其分辨率低,无法获取精细化3D结构,进而无法仅基于结构信息区分不同的神经元亚型;(2)哺乳动物大脑中单细胞转录组的出生后动态变化未得到全面的研究,目前的研究方法灵敏度低,每个细胞检测到的转录本有限;(3)现有的方法无法提供与其他组学数据集相结合的单细胞3D基因组数据的深入、综合分析。
为解决上述问题与挑战,北京大学谢晓亮团队采用基于多重退火环状循环扩增的数字转录组学(MALBAC-DT)和二倍体染色质构象捕获(Dip-C)方法绘制了小鼠脑皮层和海马体的转录组及3D基因组图谱,开发了多组学数据可视化和分析方法。该研究发现在大脑发育过程中,转录组和3D基因组均在出生后的第一个月被广泛转化,与感官体验无关。之后检查印记基因的等位基因特异性结构,揭示了局部和染色体范围的差异。以上发现揭示了神经发育的一个未知维度。该项工作以“Changes in genome architecture and transcriptional dynamics progress independently of sensory experience during postnatal brain development”为题2021年1月22日在线发表于Cell。测序中国将邀请该论文第一作者谭隆志博士于2021年2月5日进行在线直播,对该项工作进行专业解读(报名及观看直播方式见文末)。

文章发表于Cell期刊
研究者首先采用高灵敏度,高精度的MALBAC-DT方法对来自7个不同年龄(出生后1天,7天,14天,21天,28天,56天,180天 --- 即P1, P7, P14, P21, P28, P56, P180)的小鼠大脑皮层和海马体的3517个单细胞进行了单细胞转录组测序分析,平均每个细胞检测12.8k个mRNA分子和3.4k个基因。随后对转录组多样性进行可视化及聚类分析,共鉴定出4种主要细胞类型:神经元、星形胶质细胞、少突胶质细胞和其他细胞(小胶质细胞和少量血管细胞)。在每个类型内,细胞主要按年龄聚类,P7和P14之间具有明显的视觉区别,这表明在出生后发生了一次重大的转录组转化。此外,研究者发现少突胶质细胞分为3种不同的亚型: 少突胶质细胞祖细胞(Pdgfra+)、新形成的少突胶质细胞(Tns3+)和成熟的少突胶质细胞(Mal+)。从P1的单一转录组类型(Pdgfra+)开始,随着时间的推移,出生后发育导致了Tns3+(P7)和Mal+ (P21)的出现;类似地,星形胶质细胞的转录组转化除了新生儿类型(Tnc+)之外,还在P14出现了更成熟的类型(“成年星形胶质细胞”; Gjb6+),这与前人研究一致(图1)。
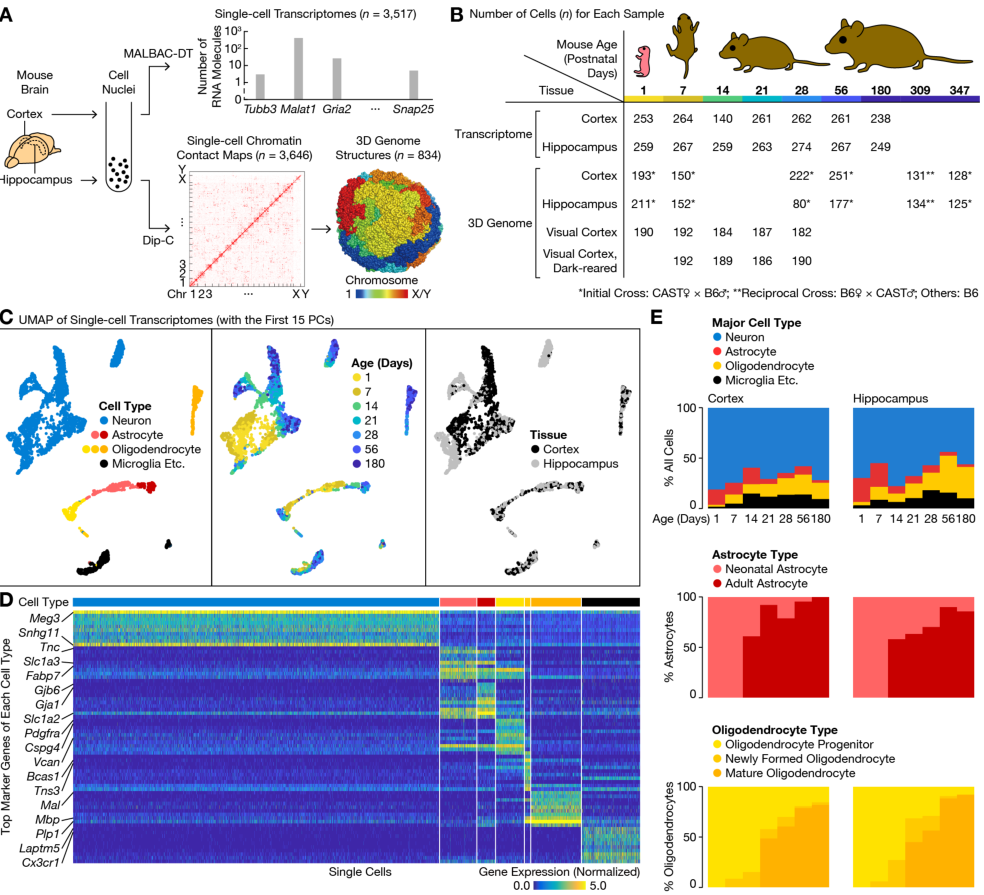
图1. 用MALBAC-DT绘制小鼠出生后前脑发育过程的单细胞转录组图谱
已知不同功能亚型的神经元,会进行不同的计算,不同大脑区域和/或不同发育阶段的神经元也会表现出不同的特性。为了研究这种多样性的转录基础,研究者分别分析了2,277个神经元,通过可视化和聚类分析发现神经元由复杂的转录组类型组成,具有不同的时间、区域和功能特异性,对于大多数亚型,可以看到在P7和P14之间具有最明显的视觉分离,尽可能合并同一亚型的不同发育阶段,可将神经元分为16个主要类型和4个未成熟类型。接下来,研究者采用主成分分析法剖析细胞间异质性的不同来源,发现了两个发育调控相关的基因模块,其中新生儿特征性基因在P1和P7高表达,在P14急剧下降,从P21起一直保持较低水平;而成人特征性基因随着时间的推移稳步增加,直到在P56左右趋于平稳。因此,这两个模块代表了神经元中两种截然不同的转录组转化模式(图2)。
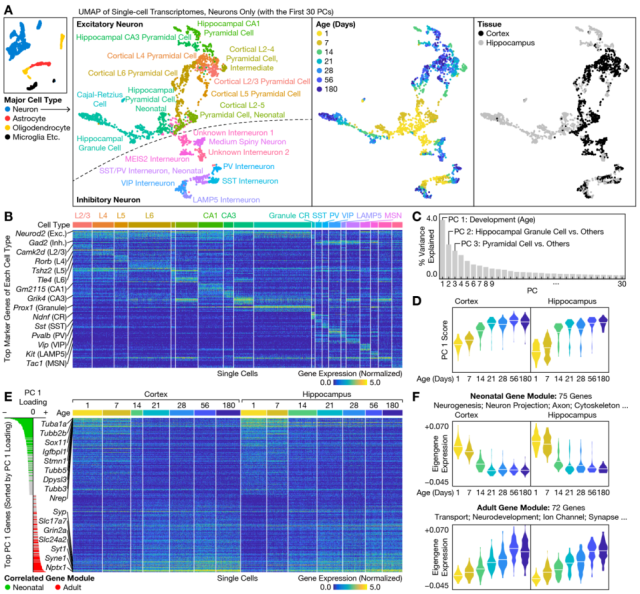
图2. 神经元之间的转录组变异
为了更好地理解转录转化的结构基础,研究者采用Dip-C方法对出生后一年内不同年龄阶段(P1, P7, P28, P56, P309, P347)的小鼠的1,954个来自大脑皮层和海马的单个细胞进行分析研究,获得了每个细胞平均401k的染色质接触,其中43%的细胞在20 kb的分辨率获得了高质量的3D结构。基于SCA/B矩阵的前20个主成分对细胞进行分层聚类,主要分为13种结构类型:8种神经元类型,2种星形胶质细胞类型,2种少突胶质细胞类型,以及1种其他类型(“小胶质细胞等”)。接下来,研究者整合单细胞转录组数据中的细胞类型特异性基因表达与单细胞3D基因组数据中的差异结构区域,结果显示上述13个结构类型与相应的转录组类型高度相关。此外,通过整合已发表的3D基因组、转录组、甲基组和染色质可及性数据,再次确认了结构类型的细胞类型同一性。最后,研究者进行了时间动力学探索,发现在P7和P28之间,神经元、星形胶质细胞和少突胶质细胞的结构类型组成发生了剧烈的变化,且与转录组的转化是一致的(图3)。
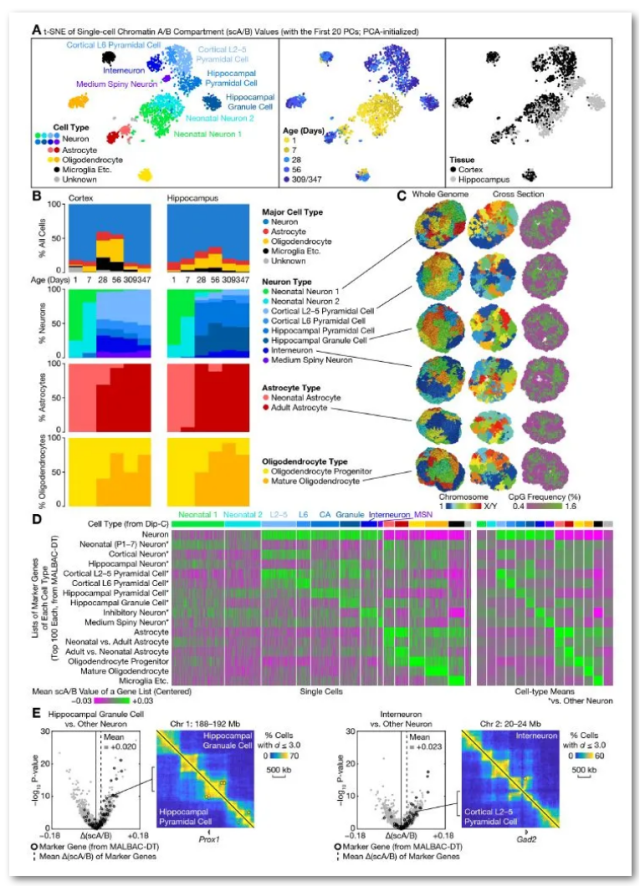
图3. 小鼠出生后前脑单细胞3D基因组图谱
接下来,研究者通过查看染色体内接触之间的接触距离分布以及染色体间接触的百分比,分析比较了新生儿和成人的结构类型。结果显示在星形胶质细胞和少突胶质细胞中,出生后发育导致了远程接触(10-100 Mb)的增加,在神经元中,接触距离的分布保持相对不变。其次,在大脑中,与新生儿类型不同,6种成人结构类型表现出特定细胞类型的放射状轮廓,基因组中的许多区域显示从新生儿到成年鼠显著向内迁移。由此,研究者提出了神经元特异性径向重组的潜在机制,猜测其可能与非CpG DNA甲基化有关。除此之外,研究者还发现单细胞染色质A/B区(scA/B)的发育变化与基因表达的变化相关,细胞类型特异性基因的3D结构在发育后期可能经历进一步的重塑(图4)。
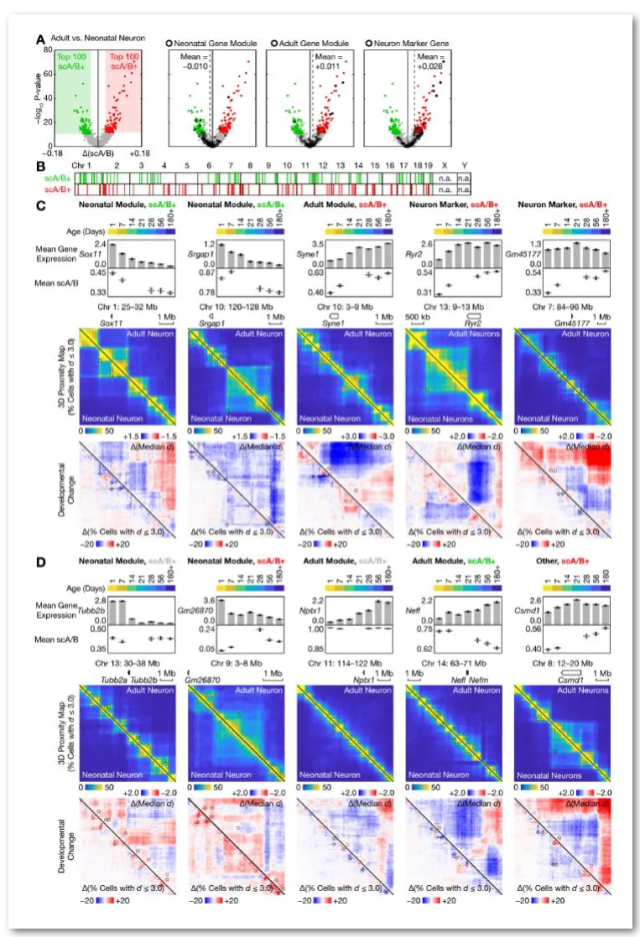
图4. 发育变化在3D基因组和转录组中的相关性
考虑到P7-P28是大脑高度可塑性并受感觉输入影响的关键时期,研究者对出生后第一个月内的5个不同年龄段(P1, P7, P14, P21, P28),的视觉剥夺小鼠(黑暗饲养)和对照组小鼠的1,692个视皮层单个细胞进行了Dip-C检测。结果显示尽管消除了视觉输入,3D基因组转化在所有3种细胞系中均正常进行,在胶质细胞中,两种情况下P14均出现成体结构类型;联合t-SNE和scA/B分析推断发现神经元正常地从新生儿的结构类型过渡到相同的3种成人类型。研究者发现感觉剥夺对scA/B几乎没有影响,在神经元方面, P1和P28之间的scA/B差异与新生神经元和成年神经元之间的差异高度相关。总之,3D基因组转化是遗传上预先决定的,不受早期生活经历的影响,且该转化在出生后第一个月内持续进行(图5)。
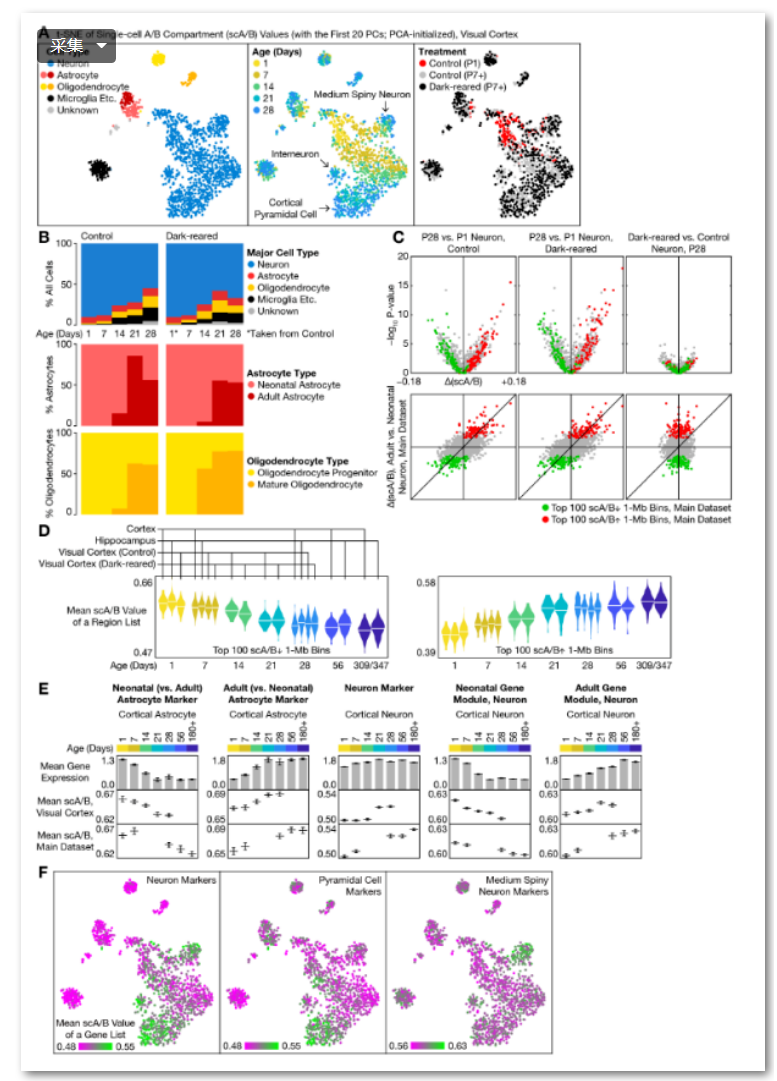
图5. 黑暗饲养小鼠和对照组小鼠视皮层的单细胞3D基因组
最后,鉴于等位基因特异性表达在大脑和整个发育过程中的关键作用,研究者通过比较正反交分析了印记基因周围特定等位基因的3D基因组结构。在小鼠大脑中已知的29个印记基因簇中,研究者在7个簇中发现了亲本特有的3D基因组结构的有力证据,在1个簇中发现了微弱证据,所有8例中,新生儿和成年细胞均相似。在极端个例中,可观察到等位基因差异从Prader-Willi / Angelman syndrome (PWS/AS)位点延伸到数十个Mbs, 这揭示了局部和染色体范围的差异(图6)。
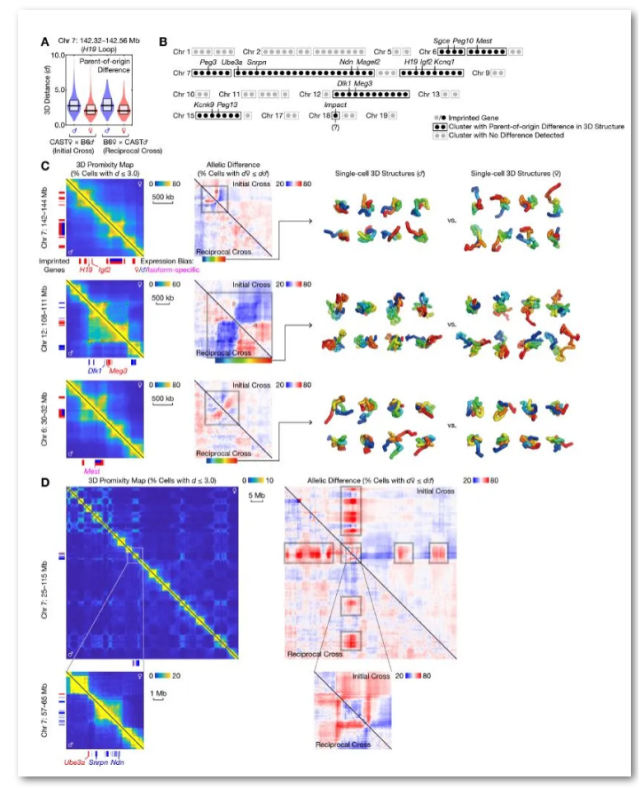
图6. 印记基因簇的亲本特异性3D基因组结构
综上所述,该研究通过绘制小鼠出生后大脑发育过程中的单细胞转录图谱及3D基因组结构图谱,阐明了功能、解剖、转录和结构细胞类型之间的相互作用,该研究结果为发育相关疾病提供了治疗机会。此外,该研究实验方法和计算工具可为生物学领域的其他研究可提供参考,使研究人员更深入地理解以及更好地设计人类基因组。
专家点评
骆利群(斯坦福大学教授,美国国家科学院院士,脑神经系统、神经生物学专家):
Tan et al. utilized state-of-the-art methods that they invented to investigate chromatin organizations at the level of single cells in developing mouse brain and make many interesting discoveries. For example, specific chromosomes in neurons but not glia move from the periphery of the nucleus towards the center as development proceeds. Indeed, they could use chromatin organization to predict cell types with high accuracy. Overall, this study highlights that brain development is accompanied by highly specific changes in chromatin structures in specific cell types. These changes appear to be genetically programmed as they are independent of postnatal experience.
中文释义:谭等人利用他们发明的最先进的方法,在发育中的小鼠大脑内,从单细胞水平研究染色质结构,并获得了很多有趣的发现。例如,神经元中的特定染色体会在发育过程中从核的外围向中心移动,而不是胶质细胞。事实上,他们可以利用染色质结构来比较准确地预测细胞类型。总体而言,这项研究表明,大脑发育伴随着特定细胞类型中染色质结构的高度特异性变化,而这些变化似乎是由基因决定的,与出生后的经历无关。
文章来源:



