来源:单细胞测序
鼻咽癌是来源于鼻咽上皮细胞的恶性肿瘤,好发于中国南方,尤其在广东地区其发病率最高,素有“广东瘤”之称。近年来随着放化疗技术的进步,鼻咽癌患者的总体生存率得到提高,但超过10%的患者最终发生复发转移。针对表皮生长因子受体和免疫检查点阻断等靶向和免疫治疗显示出一定效果,但大部分肿瘤呈现治疗抗拒,患者未能受益。患者不同的临床症状和治疗结局说明了鼻咽癌的异质性体现。针对肿瘤细胞,以往研究利用遗传学、EB病毒感染和肿瘤基因组手段揭示了鼻咽癌异质性的分子基础,然而,针对于肿瘤微环境中大量浸润的非肿瘤细胞对鼻咽癌的生物学贡献欠缺全面了解。
2021年2月2日,中山大学肿瘤防治中心贝锦新教授、曾益新院士和北京大学生物医学前沿创新中心张泽民教授在Nature Communications发表题目为“Tumour Heterogeneity and Intercellular Networks of Nasopharyngeal Carcinoma at Single Cell Resolution”。 研究报道了鼻咽癌肿瘤微环境的细胞异质性组成及其动态变化,对发现鼻咽癌患者的治疗抵抗机制和新的诊治靶点具有重要的意义。

鼻咽癌肿瘤微环境以EB病毒感染肿瘤细胞和大量免疫细胞的浸润为主要特点。该团队利用10x Genomics 5' 单细胞转录组和免疫组库(VDJ)测序技术解析鼻咽癌肿瘤微环境的异质性,依靠肿瘤和外周血配对的实验设计,利用生物信息学分析方法,详细刻画了鼻咽癌患者病人外周血与肿瘤内T细胞克隆状态,追踪鼻咽癌患者外周血与肿瘤内免疫细胞动态迁移、变化的过程,并且通过生存分析、多色免疫组化和其他单细胞转录组数据集验证了重要的发现(图1)。
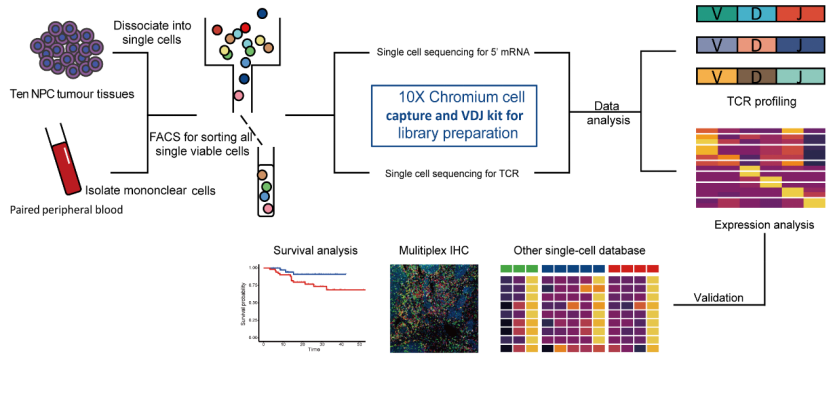
图1整体研究设计
该研究利用每个细胞的表达图谱,揭示了鼻咽癌患者外周血和肿瘤组织中的异质性程度,包括细胞类型、组分差异、T细胞的多种功能状态。通过构建T细胞受体(TCR)序列,确定了鼻咽癌中不同的T细胞克隆亚型、扩增分布、迁移和转化能力。通过伪时间序列分析和根据TCR序列的保守性,研究者发现肿瘤内耗竭的CD8+T细胞和发挥免疫抑制的调节性T细胞可能分别来源于外周血中的CX3CR1+CD8+T细胞和幼稚的调节性T细胞。CX3CR1+CD8+T细胞不仅具有高细胞毒性和高迁移能力,并且与肿瘤内浸润的CD8+T细胞共享大约10%的TCR克隆型。这些结果说明,CX3CR1+CD8+T细胞具有潜在渗透进入肿瘤组织的能力,并且可以通过TCR识别杀伤肿瘤细胞。这些结果亦提示潜在的细胞治疗策略,即可以通过在体外扩增鼻咽癌病人外周血中的CX3CR1+CD8+T细胞亚群,再回输到病人体内进行细胞治疗;或者利用CX3CR1修饰T细胞来增强T细胞的迁移和进入肿瘤的能力。
研究者鉴定了一群在肿瘤内普遍存在的、成熟的LAMP3+树突状细胞(图2)。LAMP3+树突状细胞高表达CD274(PD-L1)、PDCD1LG2(PD-L2)、CD200、IDO1等分子,这些分子被认为与免疫调节和免疫耐受相关(图2)。通过伪时间序列和转录因子分析,研究者构建了鼻咽癌病人外周血与肿瘤微环境之间树突状细胞的迁移、分化和转录因子调控网络,发现了KDM2B、KLF6、NFKB1、TRAFD1、HMGN3和JUN等转录因子对促进LAMP3+树突状细胞的成熟,降低抗原呈递能力和增强免疫调节能力至关重要(图2)。通过靶向这些转录因子可能会使LAMP3+树突状细胞重塑为正常的抗原呈递表型,从而使LAMP3+树突状细胞在鼻咽癌患者体内重新发挥激活免疫的功能。
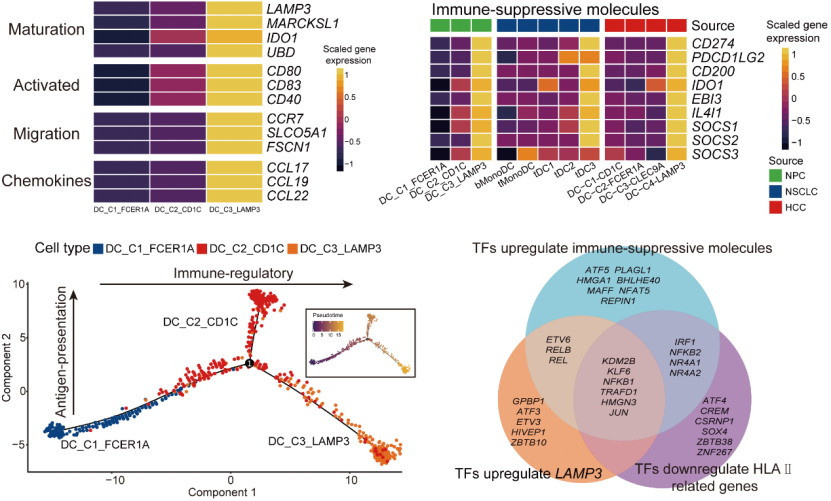
图2树突状细胞的表达谱,分化发育、迁移轨迹和转录因子调控网络
EB病毒感染是鼻咽癌在流行地区的关键特征,其在鼻咽癌肿瘤发生和发展中起着重要作用。研究者发现鼻咽癌肿瘤细胞EB病毒相关基因的表达模式存在异质性,与EBV-肿瘤细胞相比,EBV+肿瘤细胞表现出独特的转录状态,主要表现为激活了与EB病毒进入宿主相关的基因以及与癌症相关的通路,例如NF-κB和Notch通路。此外,信号通路的结果显示:EBV-肿瘤细胞与EBV+肿瘤细胞的细胞凋亡和增殖特性相反,EBV-肿瘤细胞其凋亡减弱,细胞增殖能力增强。结合细胞周期的特征与鼻咽癌病人的预后呈负相关,EBV-肿瘤细胞可能与鼻咽癌肿瘤复发和转移相关。这种EB病毒表达差异与鼻咽癌肿瘤细胞体外培养丢失EB病毒的现象是否存在一定的联系以及对于针对EB病毒的T细胞治疗鼻咽癌疗效影响值得深入探讨。
浸润的免疫细胞和肿瘤细胞不是独立和静态存在,而是在肿瘤微环境中经历复杂而动态的相互作用,从而共同促进了肿瘤的进展。研究者利用受体-配体相互作用分析发现:LAMP3+树突状细胞通过CCL17-CCR4和CCL22-CCR4招募外周血中的调节性T细胞进入肿瘤。TNFRSF4+调节性T细胞高表达的CTLA4、ENTPD1和CSF1等免疫抑制分子,与LAMP3+树突状细胞上CD80/CD86、ADORA2A和SIRPA分子结合。同时,LAMP3+树突状细胞还可以通过PDL1-PD1和CD200-CD200R信号影响耗竭的CD8+T细胞,这分别是抑制抗肿瘤反应的经典和非经典免疫抑制途径。该研究揭示了鼻咽癌中LAMP3+树突状细胞,调节性T细胞和耗竭的CD8+T细胞之间的相互作用网络,表明多种免疫细胞之间的潜在串扰可促进鼻咽癌肿瘤微环境免疫抑制机制的形成。综上所述,LAMP3+树突状细胞和调节性T细胞在鼻咽癌中发挥较强的免疫抑制作用,未来可联合作为鼻咽癌治疗靶点。
研究者观察到EBV+肿瘤细胞比EBV-肿瘤细胞与免疫细胞具有更广泛的受体-配体相互作用。EBV+肿瘤细胞在肿瘤中独特表达CX3CL1,根据受体-配体相互作用分析结果:它会与外周血中免疫细胞(包括CD8+T细胞、树突状细胞、NK细胞和单核细胞)表达的CX3CR1相互作用,表明EBV+肿瘤细胞对外周血免疫细胞具有趋化潜力。此外,研究者观察到EBV+肿瘤细胞上的EGFR被认为与多种细胞类型上的TGFB1结合,其他研究报道它可调节EB病毒的生命周期。研究者还观察到多种细胞类型通过TNF-NOTCH1和JAG2-NOTCH2与EBV+肿瘤细胞相互作用,进而导致EBV+肿瘤细胞下游Notch通路的激活,这可能与鼻咽癌肿瘤细胞的放射敏感性和肿瘤干性有关。EB病毒的感染塑造了鼻咽癌肿瘤微环境内大量免疫细胞浸润的特点,靶向EB病毒的治疗方式也是鼻咽癌治疗研究的热点之一。结合研究者发现的多病人间共有的识别EB病毒抗原的CDR3序列(CASSFSGANVLTF),该研究为后续研究者探讨靶向EB病毒感染为鼻咽癌防治策略提供了一份高分辨率和多组学的参考数据。
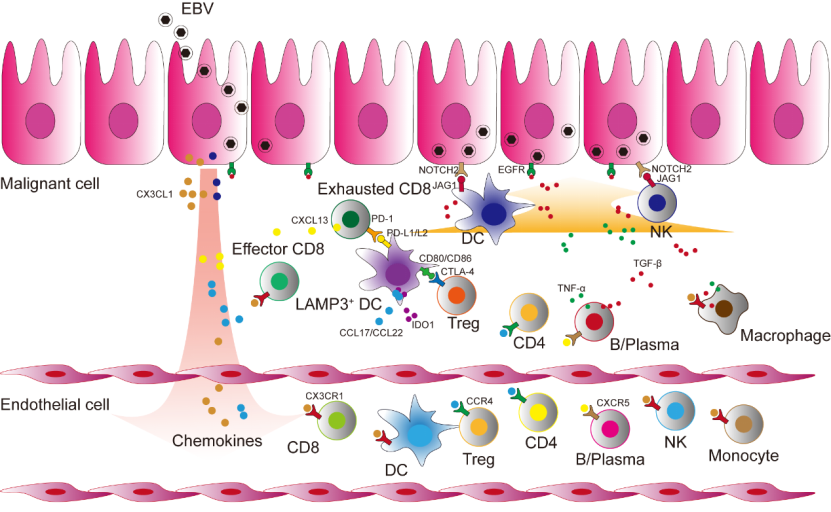
图3鼻咽癌患者外周血与肿瘤微环境中免疫细胞迁移、转化和肿瘤细胞相互作用的示意图
总之,该研究利用单细胞转录组测序技术,通过高分辨率解析鼻咽癌肿瘤微环境的异质性,鉴定了对鼻咽癌肿瘤发生过程中重要的细胞亚群和分子(图3),从而提供了对鼻咽癌致病机制和潜在治疗策略的独特见解。
中山大学肿瘤防治中心刘洋和何帅(博士生)、北京大学生物医学前沿创新中心王西亮(博士后)为共同第一作者。
原文链接:https://www.nature.com/articles/s41467-021-21043-4



